
����Ŀ��ij�������������NaCl��NaI��NH4Cl��Na2CO3��Na2SO3��Na2SO4�е�һ�ֻ�����ɣ�ȷ��ȡ4.7g�ù��������������ʵ�飨�����Լ����������������������ɱ�״������
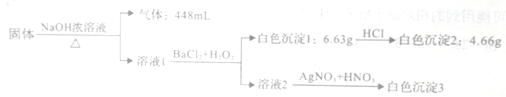
����ʵ�����������й�˵������ȷ����
A. ԭ�����������Ƿ���NaC1��ȷ��
B. ԭ���������бغ���NH4Cl��Na2CO3��Na2SO3
C. �ⶨ������ɫ����3������������ȷ�����������
D. ����Һ1��ֻ��BaCl2�������ɰ�ɫ������������С��6.63g
���𰸡�C
��������A. ���ڼ�����Լ�BaCl2����Cl�������Բ���ȷ��ԭ�����������Ƿ���NaC1����A��ȷ��B. �ù����ڼ�������������������Ũ��Һ���ò���������˵��ԭ���������к���NH4Cl����Һ1��BaCl2��H2O2�������ɵİ�ɫ����1�����������ᣬ˵����ɫ����1����̼�ᱵ�����ᱵ��ԭ���������к���Na2CO3����״����448mL���������ʵ�����0.02mol����Ӧ0.02molNH4Cl��������1.07g���ܽ�������ij���̼�ᱵ������Ϊ6.63g-4.66g=1.97g����ӦNa2CO3������Ϊ1.06g����4.66g���ᱵ��ԭ���������е�Na2SO4ת�����ɣ���Na2SO4������Ϊ2.84g�����NH4Cl��Na2CO3��Na2SO4������֮��Ϊ1.07g+1.06g+2.84g=4.97g>4.7g����ˣ�ԭ���������к���Na2SO3��Na2SO3��H2O2����ΪNa2SO4����B��ȷ��C. ����ɫ����3�������Լ�BaCl2ת���ɵ�AgCl����������ɫ����3������������������û��ֱ�ӹ�ϵ����C����ȷ��D. ����Һ1��ֻ��BaCl2������ԭ���������к���Na2SO3�������ɰ�ɫ������������С��6.63g����D��ȷ����ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ4NH3��5O2��4NO��6H2O������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)(mol��L-1��min-1)��ʾ�������й�ϵ��ȷ���ǣ� ��
A. 4v(NH3)��5v(O2) B. 6v(O2)��5v(H2O) C. 2v(NH3)��3v(H2O) D. 5v(O2)��4v(NO)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵĹ�ҵ�Ʒ���ȷ����
A.���ѣ��ý������û����Ȼ��ѣ�TiCl4����Һ�е���
B.������������¯��̼�ڸ����»�ԭ����ʯ�е���
C.���ƣ��ú�ˮ��ԭ���Ƶþ��Σ��ٵ�����ڵ��Ȼ��Ƶõ�������
D.���裺�ý�̿����������ڸ����·�Ӧ���ɴֹ�Ͷ�����̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��Ⱥ����Լ��ֺ���λ�������Ӿ�����
A.Ba(OH)2B.H2SO4C.(NH4)2SO4D.CaF2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ��ת����Ҫ���Ƿ�Ӧʵ�ʡ������Լ����ʵ���������������ת���ڸ�����������ʵ�ֵ���
��Si ![]() SiO2
SiO2 ![]() H2SiO3 ��S
H2SiO3 ��S ![]() SO2
SO2 ![]() H2SO4
H2SO4
��C ![]() CO2
CO2 ![]() Na2CO3 ��NaCl��Һ
Na2CO3 ��NaCl��Һ![]() NaCl����
NaCl����![]() Na
Na
��Na ![]() Na2O
Na2O![]() NaOH ��HCl(Ũ)
NaOH ��HCl(Ũ) ![]() Cl2
Cl2![]() Ư��
Ư��
A. �٢ڢۢ� B. �ڢۢ� C. �٢ܢݢ� D. �ڢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������ܡ����ܵ����ת�������ڻ�ѧ�������������ת����˵����ȷ���ǣ� �� 
A.��ѧ��Ӧ�������仯����Ҫԭ���ǻ�ѧ���Ķ���������
B.��ʯȼ���ǿ���������Դ��ȼ��ʱ����ѧ��ת��Ϊ����
C.��ͼI��ʾ��װ���ܽ���ѧ��ת��Ϊ����
D.��ͼII��ʾ�ķ�ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ����Ͻ�㷺Ӧ���ں��պ��졢��ͨ����ص���ҵ��
��֪��CaO(s)+3C(s)=CaC2(s)+CO(g) ��H= +464 kJ��mol-1
MgO(s)+ CaC2(s)=CaO(s)+ Mg(g)+2C(s) ��H =+177.5 kJ��mol-1
(1)þ�����ڶ�����̼��ȼ�գ�д����ѧ��Ӧ����ʽ_____________________��
(2)д��MgO(s)��C(s)����1 mol CO(g)����̬þ���Ȼ�ѧ����ʽ��________________��
(3) �õ�ⷨ��ȡþʱ����ԭ���Ȼ�þ����ˮʱ���ڵ���¶��£�ԭ�ϻ��γ�Mg(OH)Cl�����������뷴Ӧ��Mg(OH)Cl=Mg(OH)++Cl-�����ʱ������������������þ�ۻ�Ĥ����ʱ�����ķ�ӦʽΪ________________��
(4)þ/�����������ع���ʱþת��Ϊ������þ�������������ת��Ϊ����������������������������Ľṹ��ʽ��þ/�����������ص�װ�����£�
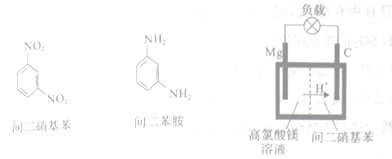
�õ�طŵ�ʱ��������Ӧ����ʽΪ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���ˮ��Һ��1molCl����ClOx��(x=1��2��3��4)������(kJ)��Դ�С��ͼ��ʾ�������й�˵����ȷ���ǣ� ��
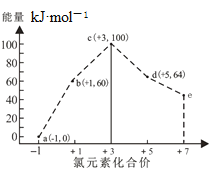
A. a��b��c��d��e�У�c���ȶ�
B. b��a+c��Ӧ�Ļ��Ϊ20kJ��mol��1
C. b��a+d��Ӧ���Ȼ�ѧ����ʽΪ3ClO��(aq)=ClO3��(aq)+2Cl��(aq) ��H=+116kJ��mol��1
D. һ���¶��£�Cl2��NaOH��Һ��Ӧ���ɵIJ�����a��b��d����Һ��a��b��d��Ũ��֮�ȿ���Ϊ11��1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����c��CH3COOH��+c��CH3COO����=0.1 molL��1��һ����ᡢ�����ƻ����Һ����Һ��c��CH3COOH����c��CH3COO������pH�Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ����������ȷ���ǣ�������
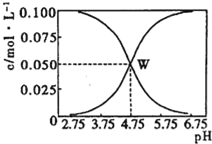
A. �����ͼʾ�����25��ʱ����ĵ���ƽ�ⳣ��Ka=10��4.75
B. W������ʾ����Һ�У�c��Na+��+c��H+��=c��CH3COOH��+c��OH����
C. pH=3.5����Һ�У�c��Na+��+c��H+����c��OH����+c��CH3COOH��=0.1 molL��1
D. ��W������ʾ��1.0 L��Һ��ͨ��0.05 molHCl���壨��Һ����仯�ɺ��ԣ���c��H+��=c��CH3COOH����+c��OH����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com