
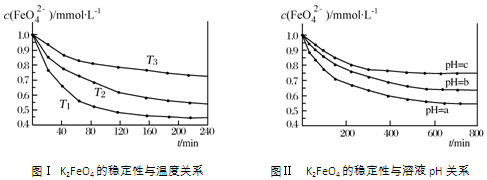
| A. | 由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱 | |
| B. | 由图Ⅰ可知温度:T1>T2>T3 | |
| C. | 由图Ⅰ可知上述反应△H<0 | |
| D. | 由图Ⅱ可知图中a<c |
分析 A、由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小;
B、由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快;
C、温度越高FeO42-浓度越小,正向反应是吸热反应;
D、pH越小,氢离子浓度越大,由4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑可知:氢离子浓度增大,平衡向正反应方向移动,高铁酸钾溶液平衡时FeO42-浓度越小,pH越小.
解答 解:A、由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,所以K2FeO4的稳定性随着温度的升高而减弱,故A正确;
B、由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,所以温度:T1>T2>T3,故B正确;
C、温度越高FeO42-浓度越小,正向反应是吸热反应,所以反应△H>0,故C错误;
D、pH越小,氢离子浓度越大,由4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑可知:氢离子浓度增大,平衡向正反应方向移动,高铁酸钾溶液平衡时FeO42-浓度越小,pH越小,所以a<c,故D正确;
故选C.
点评 本题考查学生读图获取信息的能力和化学平衡移动等,题目难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力,注意基础知识的全面掌握.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 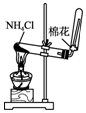 制备氨气 | B. | 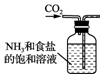 制取NaHCO3 | C. | 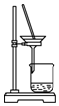 分离NaHCO3 | D. |  灼烧NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
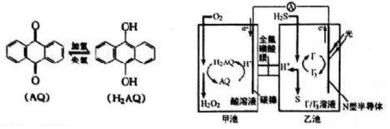
| A. | 甲池中碳棒上发生的电极反应为AQ+2H+-2e-═H2AQ | |
| B. | 乙池溶液中发生的反应为H2S+I3-═3I-+S+2H+ | |
| C. | 该装置中电能转化为光能 | |
| D. | H+从甲池移向乙池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸型酸雨的形成涉及反应:2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 常温下,0.1mol/L醋酸溶液pH≈3:CH3COOH?CH3COO-+H+ | |
| D. | Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的电子式为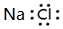 | |
| B. | NaClO只含有离子键 | |
| C. | 当释放2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内 | |
| D. | 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为:ClO-+CH3COOH=HClO+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量的气体A与气体B,所含分子数目之比为a:b | |
| B. | 气体A与气体B的摩尔质量之比为a:b | |
| C. | 相同条件下,a g气体A与b g气体B体积之比为b:a | |
| D. | 相同条件下,气体A与气体B的密度之比为b:a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做“钠与水的反应”实验时.切取绿豆大小的金属钠,用滤纸吸干表面煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| B. | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置;下层液体显紫红色;则氧化性:Fe3+>I2 | |
| C. | 测定等浓度的Na2CO3和Na2SO3 溶液的pH;前者pH 比后者的大;则非金属性:S>C | |
| D. | 溴乙烷与 NaOH 溶液共热后,加入AgNO3溶液;未出现淡黄色沉淀;说明溴乙烷没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44 g C3H8中含有的碳碳单键数为3NA | |
| B. | 标准状况下,22.4L 甲醇中含有的氧原子数为1NA | |
| C. | 1mol羟基中电子数为10NA | |
| D. | 在30 g甲醛和醋酸的混合物中,含有碳原子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com