

| 操作 | 现象 | 结论 |
| 假设一不成立 |
| 5.8g |
| 232g/mol |
| 0.075mol |
| 2 |


科目:高中化学 来源: 题型:
| A、溶液 | B、悬浊液 |
| C、胶体 | D、乳浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
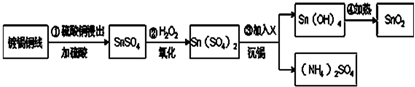
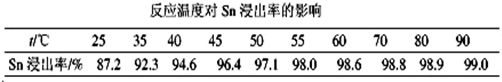
查看答案和解析>>
科目:高中化学 来源: 题型:
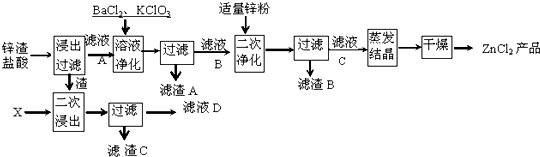
查看答案和解析>>
科目:高中化学 来源: 题型:
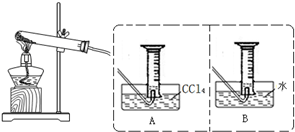 为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查阅资料:金属活泼性不同,其硝酸盐分解产物不同.
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查阅资料:金属活泼性不同,其硝酸盐分解产物不同.
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
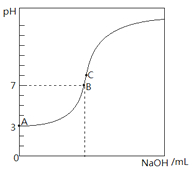 常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )
常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )| A、由图可知HA是一种弱酸,且Ka=1.0×10-5 |
| B、滴定到B点时,c(Na+)=c(A-) |
| C、当NaOH溶液的体积为10.00mL时,有c(A-)+c(OH-)=c(H+)+c(HA) |
| D、C点溶液中的离子浓度关系为:c(Na+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A、反应在前2 s 的平均速率v(CO)=0.080mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(Cl2)=0.11 mol?L-1,则正反应为放热反应 |
| C、向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆 |
| D、若起始向容器中充入1.0 mol Cl2 和0.9 mol CO,达到平衡时,Cl2的转化率大于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
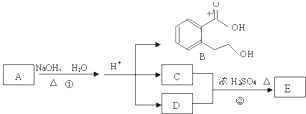 如图中 A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物.
如图中 A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Mg2+ |
| B、Fe2+、Mg2+ |
| C、Fe2+、NH4+ |
| D、Al3+、Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com