
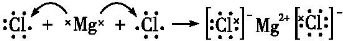 .
.分析 A、B、C、D、E五种短周期元素,A元素的离子焰色反应为黄色,则A为Na;B的最高价氧化物对应水化物B(OH)25.8g恰好能与100mL 2mol•L-1盐酸完全反应,设B的化合价为x,摩尔质量为y,则$\frac{5.8g}{y+17x}$×x=0.2,显然x=2,y=24符合,B原子核中质子数和中子数相等,则B的质子数为12,即B为Mg元素;且B原子核中质子数和中子数相等,故B为Mg;E2(氢气)在黄绿色气体C2(氯气)中燃烧产生苍白色火焰,故E为H,C为Cl;D元素原子的最外层电子数是次外层电子数的3倍,故D为O,据此解答各小题即可.
解答 解:A、B、C、D、E五种短周期元素,A元素的离子焰色反应为黄色,则A为Na;B的最高价氧化物对应水化物B(OH)25.8g恰好能与100mL 2mol•L-1盐酸完全反应,设B的化合价为x,摩尔质量为y,则$\frac{5.8g}{y+17x}$×x=0.2,显然x=2,y=24符合,B原子核中质子数和中子数相等,则B的质子数为12,即B为Mg元素;且B原子核中质子数和中子数相等,故B为Mg;E2(氢气)在黄绿色气体C2(氯气)中燃烧产生苍白色火焰,故E为H,C为Cl;D元素原子的最外层电子数是次外层电子数的3倍,故D为O,
(1)根据分析可知,B为镁元素;C为Cl,位于元素周期表中第三周期第ⅤⅡA族,
故答案为:镁;第三周期第ⅤⅡA族;
(2)AD分别为Na和O,可以形成过氧化钠,过氧化钠为淡黄色固体,过氧化钠中含有离子键、共价键,
故答案为:离子键、共价键;
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯化镁为离子化合物,用电子式表示其形成过程为: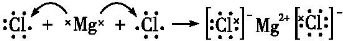
,故答案为: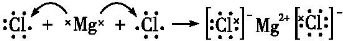 ;
;
(5)O和H构成的9e-微粒是-OH,名称是羟基,
故答案为:羟基;
(6)非金属性越强,大于氢化物越稳定,非金属性Cl大于S,则氢化物稳定性HCl>H2S,
故答案为:HCl;H2S.
点评 本题考查了位置、结构与性质的关系,题目难度中等,根据题干信息正确推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:填空题

 (填结构简式)可以合成下列二肽:
(填结构简式)可以合成下列二肽:

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑤ | C. | ①②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
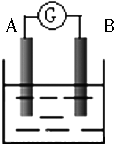 如图为原电池装置示意图:
如图为原电池装置示意图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | 最高正化合价:Y>W=Z>X | |
| B. | 原子半径:X>W>Z>Y | |
| C. | W、Y、Z的最高价含氧酸的钠盐溶液都能与CO2反应 | |
| D. | 最高价氧化物对应的水化物的酸性:Y<W<Z<X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制该溶液应用托盘天平称取12.5g胆矾 | |
| B. | 配制该溶液应用托盘天平称取8.0g胆矾 | |
| C. | 转移溶液前容量瓶内有少量蒸馏水会使所配溶液浓度偏低 | |
| D. | 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4 L苯所含的分子数为NA | |
| B. | 0.1 mol/L NaOH溶液所含的Na+数为0.1NA | |
| C. | 在常温常压下,11.2 L CH4所含的氢原子数为2NA | |
| D. | 在标准状况下,14 g氮气所含的核外电子数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 根据题意回答下列问题
根据题意回答下列问题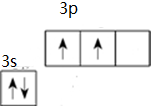 .
.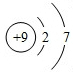 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com