
【题目】常温下,向0. 1 mol L-1 H2 A溶液中缓慢加入氢氧化钠(假设溶液体积不变),得到有关粒子的物质的量浓度分数与溶液pH值关系如图所示(M、N点对应的横坐标为6. 4和10.2)。 [![]() ]下列说法正确的是
]下列说法正确的是

A.Ka1(H2A)的数量级为10-5
B.N 点溶液中 c(Na+)>3c(HA-)
C.当溶液呈中性时,c(HA-)=c(Na+) >c(OH-)=c(H+)
D.由图可知HA-的水解程度小于电离程度
【答案】B
【解析】
A.H2A![]() H++HA-,其第一步电离平衡常数
H++HA-,其第一步电离平衡常数![]() 。根据M点溶液中c(HA)=c(H2A),则Ka1=c(H+)=10-6.4≈3.98×10-7,数量级为10-7,A错误;
。根据M点溶液中c(HA)=c(H2A),则Ka1=c(H+)=10-6.4≈3.98×10-7,数量级为10-7,A错误;
B.N点溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A-),N点溶液呈碱性,则c(H+)<c(OH-),可得c(Na+)>c(HA-)+2c(A-)。根据图示,可知c(HA-)=c(A-),可得c(Na+)>3c(HA-),B正确;
C.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A-),溶液呈中性,c(H+)=c(OH-),消去可得,c(Na+)=c(HA-)+2c(A-),则c(Na+)>c(HA-)>cOH-)=c(H+),C错误;
D.HA-的电离方程式和水解方程式分别为HA-![]() H++A2-,HA-+H2O
H++A2-,HA-+H2O![]() H2A+OH-。HA-的电离平衡常数
H2A+OH-。HA-的电离平衡常数![]() ,N点时,c(HA-)=c(A-),带入可得Ka2=c(H+),N点溶液的pH=10.2,则Ka2=c(H+)=10-10.2;HA-的水解平衡常数
,N点时,c(HA-)=c(A-),带入可得Ka2=c(H+),N点溶液的pH=10.2,则Ka2=c(H+)=10-10.2;HA-的水解平衡常数![]() ,根据A项中的计算,Ka1≈3.98×10-7,带入数据,
,根据A项中的计算,Ka1≈3.98×10-7,带入数据,![]() ,可知HA-的水解程度大于电离程度,D错误。
,可知HA-的水解程度大于电离程度,D错误。
答案选B。


科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
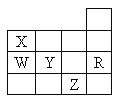
A. 常温常压下五种元素的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子相同
C. W的氢化物的热稳定性比X的氢化物的热稳定性高
D. Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和石油不仅是重要的矿物能源,更可以通过综合利用得到多种有机化工产品。
(一)乙烯是石油化工最重要的基础原料,请根据以下框图回答:
![]()
(1)乙烯分子的空间结构是_____________;C官能团名称是__________________。
(2)与乙烯和氢气的加成产物互为同系物的是_______(填写编号)。
a. C2H2 b. C6H6 c. C5H12 d. C2H6O
(3)A→B的化学方程式____________________________________。
(4)A+C→乙酸乙酯的化学方程式____________________________________。
(5) “乙烯→A”的反应类型是__________反应。下列物质在一定条件下都能与乙烯反应,其中反应类型与“乙烯→A”的不相同的是_____________(填序号)。
a.氢气 b.氯化氢 c.氧气 d.溴水
(6)实验室常用乙醇和浓硫酸共热制取乙烯,温度必须控制在_______________℃,加热时要使温度迅速上升至所需温度,其原因是____________________________________;实验时常在烧瓶中加入碎瓷片,目的是_______________________;实验室常用_________________法收集乙烯。
(二)煤焦油中可以分离出一种重要的液态烃——苯。
苯和液溴可以发生反应。根据下图装置回答:
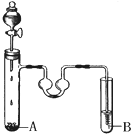
(1)现代化学认为苯分子中的碳碳键是________________________________________。
(2)反应时A试管内须放些铁丝,铁丝的作用是__________________________,A试管中发生的反应的化学方程式是 __________________________________________。
(3)双球U型管里盛放的液体是CCl4,其作用是_________________________________。
(4)当B试管盛放的是_____________(填序号),看到的现象是__________________,就可以证明该反应是取代反应。
a.硝酸银溶液 b.石蕊溶液 c.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.2.0gD2中含有的中子数目为0.8NA
B.4.6gC2H6O中含有C—H键的数目一定为0.6NA
C.11.2L(标准状况)由甲烷和乙烯组成的混合气体中含有氢原子数目为2NA
D.常温下,将2.8gFe置于足量的浓硝酸中,转移的电子数目—定为0.15NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短同期主族元素X、Y、Z、W的原子序数依次增大。Z的简单离子半径在同周期中最小,25 ℃时, 0.01 molL 1 X、W的最高价氧化物对应的水化物溶液的pH和原子半径的关系如图所示,Y和W 同主族。下列说法错误的是 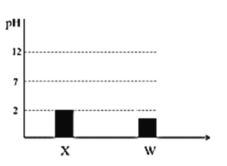
A.原子半径的大小顺序为Z>W>X>Y
B.元素Y分别与X、W元素至少形成两种化合物
C.Y、Z形成的化合物既能和酸反应又能和碱反应
D.X、Y、W对应的简单氢化物中,X的氢化物最稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化苯(基)硒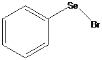 有剧毒,是一种合成有机硒化合物的重要中间体。可由乙酸基笨基硒在四氯化碳中与溴反应经乙酸处理得到,回答下列问题:
有剧毒,是一种合成有机硒化合物的重要中间体。可由乙酸基笨基硒在四氯化碳中与溴反应经乙酸处理得到,回答下列问题:
(1)Br原子核外能量高的能层符号是__________,其基态原子价电子排布式为_______。
(2)C、N、O三种原子的第一电离能由大到小的顾序为_______。
(3)乙酸分子中碳原子的杂化方式为_______。
(4) H2Se的沸点_______(填“>”“<”或“=”)H2S,原因是_______。
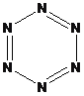
(5)晶体氮(N6)的结构如下图所示,其熔点为70℃,晶体氮中存在的作力有_______。
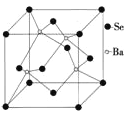
(6)BaSe可用于光电池,其晶胞结构如上图所示,晶胞参数a=0.786nm,NA代表阿伏加徳罗常数,列式计算BaSe晶胞密度为____gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.60g冰醋酸和果糖的混合物中含氧原子的数目为2NA
B.标准状况下,33.6LCHCl3中含有的共价键的数目为6NA
C.常温下,将2.7gAl投入足量的浓硝酸中,转移电子数为0.3NA
D.78gH2SiO3胶体中含有的胶粒数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
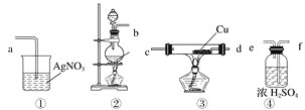
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有铁、氧化铁、四氧化三铁的混合物3.64克,加入50mL2mol/L盐酸溶液时,恰好完全反应,并且生成气体的体积在标准状况下为0.224升,向所得溶液中滴加KSCN溶液无明显变化。若将等质量的该混合物在CO中加热并充分反应,冷却后固体的质量为( )
A. 2 .8克 B. 1.52克 C. 3.4克 D. 2克
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com