
(13分)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
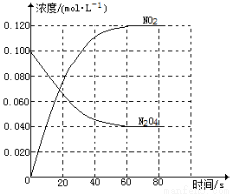
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为 mol?L-1?s-1反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol?L-1?s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②列式计算温度T时反应的平衡常数K2 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 ________(填“正反应”或“逆反应”)方向移动,判断理由是 。
(13分)答案(1) 大于 (1分) 0.0010 (2分) 0.36 mol·L-1 (2分)
(2)①大于(1分) 反应正方向吸热,反应向吸热方向进行,故温度升高(2分)
②K2= (0.16 mol·L-1)2/(0.020 mol·L-1) =1.3 mol·L-1 (2分)
(3) 逆反应 (1分) 对气体分子数增大的反应,增大压强平衡向逆反应方向移动(2分)
【解析】
试题分析:(1)随温度升高,混合气体的颜色变深,平衡向正反应方向移动,正反应吸热,反应的△H大于0;在0~60s时段,N2O4的浓度从0.100mol/L降为0.040mol/L,反应速率v(N2O4)=(0.100mol/L-0.040mol/L)/60s=0.0010 mol?L-1?s-1;反应的平衡常数K1=(0.120 mol?L-1)2/0.040 mol?L-1=0.36 mol·L-1 ;(2)改变反应温度为T后,c(N2O4)以0.0020 mol?L-1?s-1的平均速率降低,平衡向正反应方向移动,正反应吸热,所以升高的温度,①T大于100℃;②再次平衡后,Δc(N2O4)=0.0020 mol?L-1?s-1×10s=0.020 mol?L-1?,c(N2O4)=0.040 mol?L-1-0.020 mol?L-1=0.020 mol?L-1,c(NO2)=0.120 mol?L-1?+0.020 mol?L-1?×2=0.160 mol?L-1?,则K2= (0.16 mol·L-1)2/(0.020 mol·L-1) =1.3 mol·L-1 ;(3)温度T时反应达平衡后,将反应容器的容积减少一半,相当于增加了压强,平衡向体积减小的方向即逆反应方向移动。
考点:化学平衡


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下列各烃分别与H2完全加成,不能生成2,2,3—三甲基戊烷的是:
A.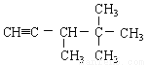
B.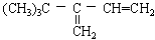
C.CH2=CHC(CH3)2CH(CH3)2
D.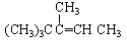
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:选择题
在0.1mol·L-1的HCN溶液中存在如下电离平衡HCN H++CN-,对该平衡,下列叙述正确的是
H++CN-,对该平衡,下列叙述正确的是
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,平衡向逆反应方向移动
C.滴加少量0.1mol·L-1 HCl溶液,溶液中c(H+)减少
D.加入少量NaCN固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省校高一上学期期中化学试卷(解析版) 题型:选择题
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是
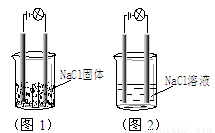
A.NaCl是非电解质
B.将图2中的NaCl溶液换成液态HCl,灯泡也亮
C.将图2中的NaCl溶液换成SO2的水溶液,灯泡也亮,说明SO2是电解质
D.电解质本身不一定能导电
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省校高一上学期期中化学试卷(解析版) 题型:选择题
下列实验操作中错误的是
A.蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省蒙自市高二上学期期中化学试卷(解析版) 题型:选择题
某温度时,测得纯水中c(H+)=2.4×10-7 mol·L-1,则c(OH-)为
A.2.4×10-7 mol·L-1 B.1.0×10-7 mol·L-1
C.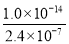 mol·L-1 D.无法确定
mol·L-1 D.无法确定
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省蒙自市高二上学期期中化学试卷(解析版) 题型:选择题
在恒温恒压、不做功时,反应A+B= C+D在下列哪种情况下,一定能自发进行
A.ΔH<0、ΔS<0 B.ΔH>0、ΔS<0
C.ΔH<0、ΔS>0 D.ΔH>0、ΔS>0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高二上学期期中化学试卷(解析版) 题型:选择题
关于用水制取二级能源氢气,以下研究方向不正确的是
A.水由氢氧两种元素构成,可研究在水分解的情况下,使氢能成为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找特殊化学物质,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源以分解水制取氢气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省校高二上学期期中化学试卷(解析版) 题型:填空题
(19分)(1)已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ,则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) kJ的热量。
(2)已知在常温常压下:
①CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H1=-442.8 kJ/mol
②2CO(g)+O2(g)=2CO2(g);ΔH2 =-566.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式__________________________________________
(3)已知合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);ΔH= -92.2 kJ·mol-1
2NH3(g);ΔH= -92.2 kJ·mol-1
下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1
③此条件下该反应的化学平衡常数K= (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com