
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10 -1 | 1.7×10 -5 | 6.2×10 -10 | K1=4.3×10-7 K2=5.6×10-11 |

分析 (1)依据碳酸的电离平衡常数书写;
(2)酸性溶液的pH<7、中性溶液的pH=7、碱性溶液的pH>7,且酸性越强,溶液的pH越小,碱性越强,溶液的pH越大;先根据溶液酸碱性对各物质进行分类,然后根据电解质的电离,盐的水解程度大小判断溶液中氢离子、氢氧根离子浓度,再判断溶液pH大小;
(3)CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,c(OH-)增大,Kw不变;
(4)由生成二氧化碳的曲线斜率可知HSCN反应较快,则可知HSCN中中c(H+)较大,说明HSCN酸性较强,再利用盐类水解的规律来分析离子浓度的关系;
(5)根据pH=-lgc(H+)计算出氢离子浓度,再根据Kw计算氢氧根浓度;由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;
(6)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-),根据缓冲溶液中的缓冲公式来计算$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$;
(7)次氯酸酸性大于HCO3-,小于碳酸,少量CO2通入次氯酸钠溶液中反应生成碳酸氢钠和次氯酸.
解答 解:(1)碳酸的第一级电离平衡常数表达式:K1=$\frac{[HC{{O}_{3}}^{-}]•[{H}^{+}]}{[{H}_{2}C{O}_{3}]}$;
故答案为:$\frac{[HC{{O}_{3}}^{-}]•[{H}^{+}]}{[{H}_{2}C{O}_{3}]}$;
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液,依据酸的电离平衡常数比较酸性强弱为:HSCN>CH3COOH>H2CO3>HCN>HCO3-;水解程度SCN-<CH3COO-<HCO3-<CN-<CO32-;
溶液的pH由大到小的顺序为cbda;
故答案为:cbda;
(3)A.CH3COOH溶液加水稀释过程,虽促进电离,但c(H+)减小,故A不选;
B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{n({H}^{+})}{n(C{H}_{3}COOH)}$,CH3COOH溶液加水稀释过程,促进电离,氢离子物质的量增大,醋酸物质的量减小,则稀释过程中比值变大,故B选;
C.稀释过程,c(H+)减小,c(OH-)增大,c(H+)•c(OH-)=Kw,Kw只受温度影响所以不变,故C不选;
D.稀释过程,c(H+)减小,c(OH-)增大,则$\frac{c(O{H}^{_})}{c({H}^{+})}$变大,故D选;
故答案为:BD;
(4)由Ka(CH3COOH)=1.8×10-5和Ka(HSCN)=0.13可知,CH3COOH的酸性弱于HSCN的,即在相同浓度的情况下HSCN溶液中H+的浓度大于CH3COOH溶液中H+的浓度,浓度越大反应速率越快;又酸越弱,反应生成的相应的钠盐越易水解,即c(CH3COO-)<c(SCN-),
故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;<.
(5)根据pH=-lgc(H+)=2,则氢离子浓度为10-2,又Kw=c(H+)c(OH-)=10-14,所以氢氧根浓度为10-12;由图可知,稀释相同的倍数,pH变化大的酸酸性强,由图可知,HX的pH变化程度小,则HX酸性弱,电离平衡常数小,醋酸酸性强,电离程度大,则HX的电离平衡常数 小于CH3COOH的电离平衡常数.
故答案为:小于;
(6)CH3COOH与CH3COONa的混合溶液中,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7mol/L;
根据缓冲公式pH=pKa-lg($\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$),25℃时CH3COOH的 Ka=1.8×10-5,pKa(CH3COOH)=4.76,所以lg($\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$)=-1.24,即$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18,
故答案为:9.9×10-7;18;
(7)次氯酸酸性大于HCO3-,小于碳酸,少量CO2通入次氯酸钠溶液中反应生成碳酸氢钠和次氯酸,反应的离子方程式为:CO2+H2O+ClO-=HCO3-+HClO;
故答案为:CO2+H2O+ClO-=HCO3-+HClO.
点评 本题考查弱电解质的电离、盐类水解的关系,酸碱混合的定性判断,注意平衡常数K只与温度有关,题目以图象题的形式较好的训练学生利用信息来分析问题、解决问题的能力,注意把握题目的分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | C6H6 | B. | CH3CHO | C. | CH3COOH | D. | CH2=CH-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一电离能 | 电负性 | 稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
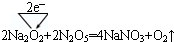 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH | B. | HNO3 | C. | CH3CH2OH | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{HCl(aq)}{→}$SiCl4 | |
| B. | S$→_{催化剂/△}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| D. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2$\stackrel{空气中放置}{→}$Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 6.830 | 13.660 | 30.000 |
| 二氧化硫气体的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.800 | 1.600 | 3.200 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com