
| A. | 1L溶液中含阴、阳离子总数是0.6NA | |
| B. | 500mL溶液中Βa2+的浓度是0.2mol•L-1 | |
| C. | 500mL溶液中NO-3的浓度是0.4mol•L-1 | |
| D. | 1L溶液中含有0.2NA个NO-3 |
分析 A、求出Ba(NO3)2的物质的量,而1molBa(NO3)2中含3mol离子;
B.离子的浓度与溶液的体积无关;
C.离子的浓度与溶液的体积无关;
D.求出Ba(NO3)2的物质的量,而1molBa(NO3)2中含2molNO3-.
解答 解:A、1L溶液中Ba(NO3)2的物质的量n=CV=0.2mol/L×1L=0.2mol,而1molBa(NO3)2中含3mol离子,故0.2molBa(NO3)2中含0.6mol离子,含阴、阳离子总数是0.6NA,故A正确;
B.离子的浓度与溶液的体积无关,故0.2mol/LBa(NO3)2溶液中Ba2+的浓度为0.2mol/L,故B正确;
C.离子的浓度与溶液的体积无关,故0.2mol/LBa(NO3)2溶液中NO3-的浓度为0.4mol/L,故C正确;
D.1LBa(NO3)2的物质的量n=CV=0.2mol/L×1L=0.2mol,而1molBa(NO3)2中含2molNO3-,故0.2molBa(NO3)2中含0.4molNO3-,故D错误;
故选D.
点评 本题考查了物质的量浓度的含义、微粒物质的量和浓度的计算应用,掌握基础是解题关键,题目难度不大.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:推断题
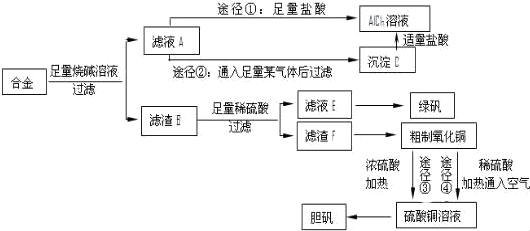
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质在酶的作用下水解的最终产物为氨基酸 | |
| B. | 向蛋白质溶液加入(NH4)2SO4浓溶液,会使其变性 | |
| C. | 天然蛋白质仅由碳、氢、氧、氮四种元素组成 | |
| D. | 氨基酸和蛋白质都是只能和碱反应的酸性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
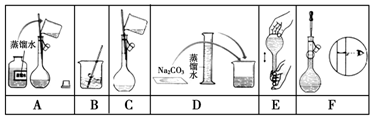
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
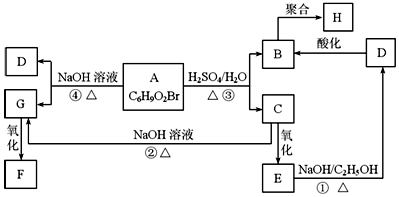 有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.
有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.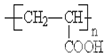 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
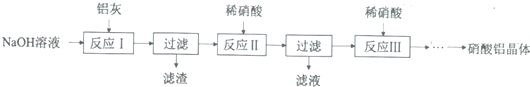
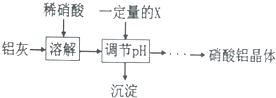
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com