
| A. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,该反应的热化学方程式是 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.4 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石一定比石墨稳定 | |
| C. | 已知:断裂1mol H2(g)、1molCl2(g)、1molHCl(g)中化学键吸收的能量分别是E1、E2、E3,则H2(g)+Cl2 (g)=2HCl(g)的反应热△H=2×E3-(E1+E2) | |
| D. | 已知C(s)+O2(g)=CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)=2CO(g),△H=b kJ•mol-1,则2CO(g)+O2(g)=2CO2(g)△H=(2a-b) kJ•mol-1 |
分析 A.中和反应为放热反应,焓变应该为负值;
B.物质具有能量越高,其稳定性越弱;
C.焓变△H=反应物总键能-生成物总键能;
D.根据盖斯定律构造热化学方程式,然后计算出其焓变.
解答 解:A.含20.0g NaOH(0.5mol)的稀溶液与稀盐酸完全中和,生成0.5mol水放出28.7 kJ的热量,则生成1mol水放出的热量为57.4kJ,该反应正确的热化学方程式是:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,故A错误;
B.已知C(石墨,s)=C(金刚石,s)△H>0,该反应为吸热反应,说明石墨具有的能量小于金刚石,则金刚石一定不如石墨稳定,故B错误;
C.已知:断裂1mol H2(g)、1molCl2(g)、1molHCl(g)中化学键吸收的能量分别是E1、E2、E3,则热化学方程式H2(g)+Cl2 (g)=2HCl(g)的反应热为:△H=(E1+E2)-2×E3,故C错误;
D.已知①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1,②2C(s)+O2(g)=2CO(g),△H=b kJ•mol-1,根据盖斯定律,①×2-②可得:则2CO(g)+O2(g)=2CO2(g)△H=(2a-b) kJ•mol-1,故D正确;
故选D.
点评 本题考查了热化学方程式的书写方法及应用,题目难度中等,明确反应热与焓变的关系为解答关键,注意掌握盖斯定律的内容及应用方法,试题侧重考查学生的分析能力及灵活应用能力.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:实验题
 工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯
工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯查看答案和解析>>
科目:高中化学 来源: 题型:实验题
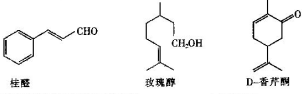
 .
.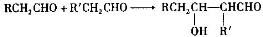
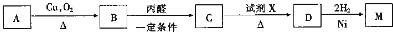
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1摩醋酸(CH3COOH)的质量与NA个醋酸分子的质量相等 | |
| B. | NA个氧分子和NA个氢分子的质量比等于16:1 | |
| C. | 28 g氮气所含的原子数目为NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占体积约是11.2 L |
查看答案和解析>>
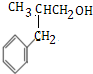
科目:高中化学 来源: 题型:解答题
 电石气的结构式H-C≡C-H
电石气的结构式H-C≡C-H .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com