
| 消耗量 |
| 起始量 |
| n |
| V |
| 1mol |
| 5mol |
| 3mol |
| 4L |


科目:高中化学 来源: 题型:
| A、容器内气体密度保持不变 |
| B、v正(N2)=3 v逆(H2) |
| C、混合气体平均相对分子质量不变 |
| D、氨气的浓度是氮气浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲溶液含有Ba2+ |
| B、乙溶液不含SO42- |
| C、丙溶液不含Cl- |
| D、丁溶液含有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | Zn(OH)2 | ZnS | AgCl | Ag2S | MgCO3 | Mg(OH)2 |
| 溶度积 | 5×10-17 | 2.5×10-22 | 1.8×10-10 | 6.3×10-50 | 6.8×10-6 | 1.8×10-11 |
| A、2AgCl+Na2S═2NaCl+Ag2S | ||||
B、MgCO3+H2O
| ||||
| C、ZnS+2H2O═Zn(OH)2+H2S↑ | ||||
| D、Mg(HCO3)2+2Ca(OH)2═Mg(OH)2↓+2CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
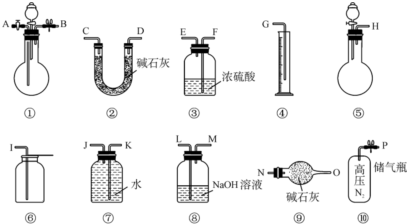
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用图1制取并收集少量的CO2 |
| B、用图2装置,检查该装置的气密性 |
| C、用100mL量筒量取20.0 mL稀硫酸 |
| D、用洁净的玻璃棒蘸取待测液,在火焰上灼烧,发现火焰为黄色,说明待测液中含有Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com