
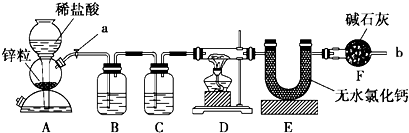
| ||
| ||
| ||
| ||
| 7.2g |
| 18g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、CuCl2溶液中加入少量氨水:Cu2++2OH-═Cu(OH)2↓ |
| B、向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-=2MnO2↓+3SO42-+2H2O |
| C、小苏打溶液中加足量澄清石灰水:HCO3?+Ca2++OH-═CaCO3↓+H2O |
| D、铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是一套检验气体性质的实验装置示意图.如图所示,向装置中缓慢通入气体X,若关闭活塞K,则试管中的品红试液无变化,而烧杯中的石灰水变浑浊;若打开活塞K,则品红试液褪色.根据此现象判断,气体X和洗气瓶内液体Y可能是( )
如图是一套检验气体性质的实验装置示意图.如图所示,向装置中缓慢通入气体X,若关闭活塞K,则试管中的品红试液无变化,而烧杯中的石灰水变浑浊;若打开活塞K,则品红试液褪色.根据此现象判断,气体X和洗气瓶内液体Y可能是( )| A、③和④ | B、②和④ |
| C、①和② | D、②和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
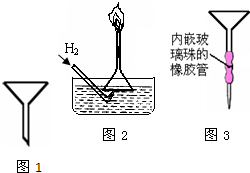 普通漏斗(见图1)是中学化学实验室常用仪器之一.我们对它的用途并不陌生.
普通漏斗(见图1)是中学化学实验室常用仪器之一.我们对它的用途并不陌生.查看答案和解析>>
科目:高中化学 来源: 题型:
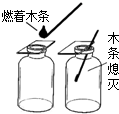 观察如图中的有关操作和现象,判断下列叙述正确的是( )
观察如图中的有关操作和现象,判断下列叙述正确的是( )| A、集气瓶中的气体可能是CO2 |
| B、集气瓶中的气体可能是空气 |
| C、集气瓶中的气体一定是O2 |
| D、集气瓶中的气体一定是N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、达到平衡后,加入催化剂C%增大 |
| B、达到平衡后,若升温平衡向左移 |
| C、m+n<e+f |
| D、达平衡后,若降压平衡向左移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com