
| A. | 从开始到平衡,A的反应速率为0.08mol•L-1•min-1 | |
| B. | 随着反应的进行,混合气体的密度逐渐减小 | |
| C. | 达到平衡时,B的转化率为20% | |
| D. | 该温度下,反应的平衡常数K=$\frac{20}{3}$ |
分析 已知:A(g)+2B(g)?C(g)+D(g)△H<0,一定温度下,2molA和2molB在2L密闭容器中反应,10min后达到平衡,结合化学三行计算得到,设A消耗物质的量为x,
A(g)+2B(g)?C(g)+D(g)
起始量(mol) 2 2 0 0
变化量(mol) x 2x x x
平衡量(mol)2-x 2-2x x x
此时容器压强降为原来的$\frac{4}{5}$,气体物质的量之比等于气体压强之比,
2-x+2-2x+x+x=$\frac{4}{5}$×(2+2)
x=0.8mol,
A.反应速率v=$\frac{△c}{△t}$=;
B.反应前后气体体积不变,气体质量不变,密度ρ=$\frac{m}{V}$;
C.转化率=$\frac{消耗量}{起始量}$×100%;
D.平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积.
解答 解:已知:A(g)+2B(g)?C(g)+D(g)△H<0,一定温度下,2molA和2molB在2L密闭容器中反应,10min后达到平衡,结合化学三行计算得到,设A消耗物质的量为x,
A(g)+2B(g)?C(g)+D(g)
起始量(mol) 2 2 0 0
变化量(mol) x 2x x x
平衡量(mol)2-x 2-2x x x
此时容器压强降为原来的$\frac{4}{5}$,气体物质的量之比等于气体压强之比,
2-x+2-2x+x+x=$\frac{4}{5}$×(2+2)
x=0.8mol,
A.从开始到平衡,A的反应速率v=$\frac{△c}{△t}$=$\frac{\frac{0.8mol}{2L}}{10min}$=0.04mol•L-1•min-1,故A错误;
B.反应前后气体体积不变,气体质量不变,密度ρ=$\frac{m}{V}$,随着反应的进行,混合气体的密度始终不变,故B错误;
C.达到平衡时,B的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{2×0.8mol}{2}$×100%=80%,故C错误;
D.K=$\frac{\frac{0.8}{2}×\frac{0.8}{2}}{\frac{2-0.8}{2}×(\frac{2-2×0.8}{2})^{2}}$=$\frac{20}{3}$,故D正确;
故选D.
点评 本题考查了化学平衡的计算,题目难度中等,明确气体压强之比等于气体物质的量之比为解答关键,注意掌握三段式在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 若a≥2b,发生的反应化学方程式为:2C2H2+O2═4C+2H2O | |
| B. | 若($\frac{2}{5}$)b<a<($\frac{2}{3}$)b,燃烧后在密闭容器中加入含amolCa(OH)2的石灰水,发生反应的离子方程式为:OH-+CO2═HCO3- | |
| C. | 若a<($\frac{2}{5}$)b,燃烧过程中转移的电子的物质的量为10amol | |
| D. | 若a=($\frac{1}{2}$)b,燃烧产物既有CO2又有CO,且n(CO2):n(CO)=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和石墨互为同素异形体,熔点和硬度都很高 | |
| B. | 氕、氘、氚是氢元素的三种核素,质子数都是1 | |
| C. | 乙醇和二甲醚(CH3-O-CH3)互为同系物 | |
| D. | C4H10的一氯代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
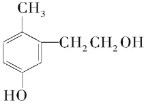
| A. | 它是苯酚的同系物 | |
| B. | 1 mol该物质能与溴水反应消耗2molBr2发生取代反应 | |
| C. | 1 mol该有机物能与足量金属钠反应生成0.5mol H2 | |
| D. | 1 mol该有机物能与2molNaOH反应 | |
| E. | 该物质在加热条件下可以与铜反应生成一种具有醛基的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
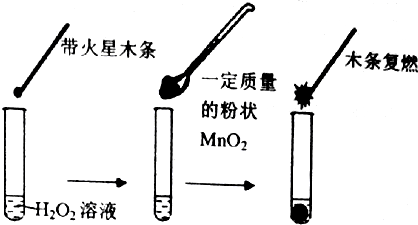
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 豆类、糙米、谷物 | B. | 胡萝卜、水果、猪肝 | ||
| C. | 肉、蛋、奶 | D. | 新鲜蔬菜、黄玉米、黄豆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe和醋酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 大理石和稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | FeCl2溶液与Cl2的反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com