
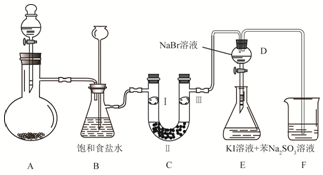
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
(2)浓盐酸具有易挥发性,制备的氯气中含有氯化氢和水蒸气,依据氯化氢、氯气在饱和食盐水中溶解度不同,选择饱和食盐水除去氯化氢;监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,据此判断现象;
(3)当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为橙色,则氯气与溴化钠反应生成溴和氯化钠,依据氧化反应中氧化剂氧化性大于氧化产物判断;
(4))打开活塞,将装置D中少量溶液加入装置E中,生成的溴单质和碘化钾反应生成碘单质,碘单质溶解于苯中,苯与水互不相溶,密度小于水,据此判断现象;
(5)氯气有毒,直接排放能够引起空气污染,依据氯气能够与氢氧化钠反应,可被氢氧化钠吸收,所以可以用氢氧化钠溶液吸收氯气.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有易挥发性,制备的氯气中含有氯化氢和水蒸气,依据氯化氢、氯气在饱和食盐水中溶解度不同,利用饱和食盐水除去氯气中的氯化氢;
装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,B中长颈漏斗中液面上升,形成水柱,故答案为:除杂和安全瓶;锥形瓶中液面下降,长颈漏斗中液面上升;
故答案为:除去氯气中的氯化氢;锥形瓶中液面下降,长颈漏斗中液面上升;
(3)当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为橙色,则氯气与溴化钠反应生成溴和氯化钠,方程式:2NaBr+Cl2=2NaCl+Br2,反应中氯气为氧化剂,溴为氧化产物,依据氧化反应中氧化剂氧化性大于氧化产物,可知氯气氧化性大于溴,单质氧化性越强,元素非金属性越强,所以可说明:氯的非金属性大于溴;
故答案为:氯的非金属性大于溴;
(4)打开活塞,将装置D中少量溶液加入装置E中,生成的溴单质和碘化钾反应生成碘单质,碘单质溶解于苯中,苯与水互不相溶,密度小于水,所以会看到现象为:E中溶液分为两层,上层(苯层)为紫红色;
故答案为:E中溶液分为两层,上层(苯层)为紫红色;
(5)氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠反应,可被氢氧化钠吸收,所以可以用氢氧化钠溶液吸收过量氯气,进行尾气处理;
故答案为:氢氧化钠溶液.
点评 本题考查了氯气实验室制取、氯气化学性质、实验设计、实验装置的理解评价、化学方程式的书写等,是对所学知识的综合运用,注意基础知识的掌握,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m≥n | B. | 所得溶液中的溶质是NaAlO2、NaOH | ||
| C. | 固体是Al(OH)3 | D. | 固体是单质铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碳棒连接电源的正极,另一电极用铜片 | |
| B. | 用铜片连接电源的正极,另一电极用铂片 | |
| C. | 阳极反应式为:Cu-2e═Cu2 | |
| D. | 阴极反应式为:2H++2e═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
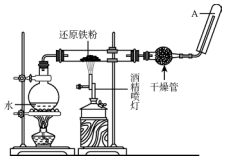 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2→H2SO4 | B. | SiO2→H2SiO3 | C. | Al2O3→Al(OH)3 | D. | Fe2O3→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 说明AgCl没有完全电离,AgCl是弱电解质 | |
| B. | 说明溶解的AgCl已完全电离,是强电解质 | |
| C. | 说明Ag+与Cl-反应不能完全进行到底 | |
| D. | 说明AgCl(s)与Ag+、Cl-共存,v溶解=v沉淀=0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com