
【题目】下列说法正确的是
A. 凡是放热反应都是自发的,吸热反应都是非自发的
B. 自发反应一定是熵增大,非自发反应一定是熵减少或不变
C. 自发反应在任何条件下都能实现
D. 自发反应在恰当条件下才能实现
科目:高中化学 来源: 题型:
【题目】甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。

(1)B中反应的离子方程式是________________________________________________。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验。取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在__________________。
(3)资料显示:SCN -的电子式为 ![]() 。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
②甲同学通过实验证明了SCN―中氮元素转化为NO3― ,已知SCN―中碳元素没有被氧化,若SCN―与Cl2反应生成0.5mol CO2,则转移电子的物质的量是_______________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液pH的变化是
A. 前者减小后者不变B. 前者减小后者增大C. 都不变D. 都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol/L的硫酸,其他试剂任选。填写下列空白。
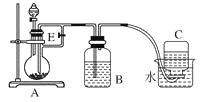
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是____________,A中反应的离子方程式是:_________。
(2)实验开始时就先将活塞E______(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
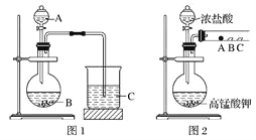
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以将反应Zn+Br2ZnBr2设计成蓄电池,有下列四个电极反应:①Br2+2e==2Br ②2Br2e== Br2 ③Zn2e==Zn2+ ④Zn2+ +2e== Zn,其中表示放电时的正极反应(即充电时的阳极)和放电时的负极反应的分别是
A. ②和③B. ②和①C. ③和①D. ④和①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃时,将ag NH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg·cm-3,溶质的质量分数为w,其中含NH4+的物质的量为bmol。下列叙述中正确的是( )
A. 溶质的质量分数为w=![]() ×100%
×100%
B. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
C. 溶液中c(OH-)=![]() mol·L-1
mol·L-1
D. 上述溶液中再加入VmL水后,所得溶液溶质的质量分数大于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中能量变化的趋势与图一致的是( )

A. C + CO2![]() 2CO
2CO
B. CaCO3![]() CaO + CO2↑
CaO + CO2↑
C. 2Al + Fe2O3![]() 2Fe + Al2O3
2Fe + Al2O3
D. Ba(OH)2·8H2O + 2NH4Cl==BaCl2 + 2NH3↑+ 10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫有多种化合物,如H2S、COS(羰基硫)、SO2等,它们对环境均有一定的影响。
(1)H2S经 K2CO3溶液吸收后,生成两种酸式盐。其中无氧酸的酸式盐的化学式是________________。
(2)COS(羰基硫)燃烧时有SO2生成,其原理为:2COS+3O2![]() 2CO2+2SO2。若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是_________________mol。
2CO2+2SO2。若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是_________________mol。
(3)电厂排出的烟气中含有CO、SO2等。它们在一定条件下可转化为一种固体和一种无害气体。该反应的化学方程式是______________________________。其中氧化剂与还原剂物质的量之比为______________。
(4)石灰石作为脱硫剂,可有效吸收废气中的SO2,减少酸雨的产生。
①在煤炭中加入石灰石可减少燃烧时SO2的排放量,并生成CaSO4。该反应的化学方程式是____________。
②你认为减少酸雨产生的途径可采取的措施是____________________(填序号)。
a.避免直接用高硫煤作燃料 b.把工厂的烟囱造高
c.燃料脱硫 d.开发新能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com