
下列化学反应在理论上可设计成原电池是
A.2Al(s) + 2NaOH(aq) +2H2O(l) == 2NaAlO2(aq) + 3H2(g) △H<0
B.HNO3(aq) + KOH(aq) == KNO3(aq) + H2O(l) △H<0
C.Ba(OH)2·8H2O(s) + 2NH4Cl(s) == BaCl2(aq)+ 2NH3·H2O(aq)+ 8H2O(l) △H﹥0
D.Na2O(s)+ H2O(l) == 2NaOH(aq) △H<0
科目:高中化学 来源:2015-2016学年江苏省盐城市高一上学期期中考试化学试卷(解析版) 题型:填空题
用18.4 mol·L-1的浓H2SO4配制100mL浓度为1 mol·L-1的稀H2SO4,其操作可分为以下各步:
A.用量筒量取5.4ml浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒搅拌;
B.用约30mL蒸馏水,分成3次洗涤烧杯和玻棒,将每次洗涤液都注入容量瓶中;
C.将稀释后的H2SO4小心转移到100mL容量瓶里;
D.检查100mL容量瓶口部是否会发生滴漏;
E.用量筒加蒸馏水至容量瓶中液面接近刻度2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴加蒸馏水至液面最低点和刻度线相平,试填空
①正确的操作顺序为(用字母填写)___________________。
②进行A步操作时,应选择下列量器______________(填序号)。
a.10ml量筒 b.50ml量筒 c.100ml量筒
如果对装有浓H2SO4的量筒读数如图所示,配制的稀H2SO4的浓度将_______________(偏高、偏低、无影响)

③进入A步操作后,必须___________________后才能进行C操作。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上第三次月考化学试卷(解析版) 题型:选择题
某学生取某物质溶于水,制得无色透明溶液,进行以下实验:①与碱反应生成盐和水;②与铁反应生成氢气;③该溶液中阳离子只有H+。根据你学过的酸的概念,其中能说明该物质为酸类物质的是:
A.①②③ B.①② C.②③ D.③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上第三次月考化学试卷(解析版) 题型:选择题
学习化学过程中需要经常做实验,下列实验操作正确的是

A.闻气味 B.倾倒液体 C.取粉末 D.过滤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上第二次月考化学试卷(解析版) 题型:选择题
下图表示的是难溶氢氧化物在不同pH下的溶解度(S/mol·L-1),下列说法中正确的是
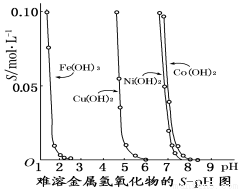
A.pH=3时溶液中铁元素的主要存在形式是Fe3+
B.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右
C.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去
D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上第二次月考化学试卷(解析版) 题型:选择题
对于0.1mol·L-1 Na2SO3溶液,正确的是
A.升高温度,溶液的pH降低
B.c(Na+)=2c(SO32―)+ c(HSO3―)+ c(H2SO3)
C.c(Na+) + c(H+) = 2c(SO32―)+ 2c(HSO3―) + c(OH―)
D.加入少量NaOH固体,c(SO32―)与c(Na+)均增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上第二次月考化学试卷(解析版) 题型:实验题
用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。
(1)滴定时应选用 作指示剂;
(2)判断到达滴定终点的实验现象是 。
(3)下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数
(4)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol·L-1的盐酸标准液进行滴定,相关数据记录如下:
实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
初读数 | 末读数 | ||
1 | 20.00 | 0.80 | 21.00 |
2 | 20.00 | 1.00 | 20.80 |
3 | 20.00 | 0.20 | 22.80 |
依据表中数据,计算出烧碱样品中含NaOH的质量分数为 %。(小数点后保留两位数字)
(5)若某样品可能由NaOH、Na2CO3、NaHCO3中的一种或两种组成,为确定其组成,某同学进行下列实验:
准确称取mg样品配制成250mL溶液,取配制好的溶液20.00mL于锥形瓶中,加入2滴酚酞作指示剂,用浓度为cmol·L-1的盐酸标准液进行滴定至终点,消耗盐酸标准液v1ml,然后再滴加2滴甲基橙继续用浓度为cmol·L-1的盐酸标准液进行滴定至终点,消耗盐酸标准液v2ml(v1和v2均不为0),
根据v1和v2数值大小判断样品的组成(用化学式表示):
①v1>v2
②v1=v2
③v1<v2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省盐城市高二上学期期中考试化学试卷(解析版) 题型:填空题
碘缺乏症遍及全球,多发生于山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜玛拉雅山区是高发病地区。我国云南、河南等十余个省的山区的发病率也较高。为控制该病的发生,较为有效的方法是加碘食盐。我国政府以国家标准的方式规定在食盐中添加碘酸钾。据此回答下面问题。
(1)碘是合成下列哪种激素的主要原料之一
A、 胰岛素 B、 甲状腺激素 C、 生长激素 D、 糖尿病
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患
A、 甲状腺机能亢进 B、 佝偻病
C、 地方性甲状腺肿 D、 雄性激素减少
(3)可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾。反应的化学方程式为:5KI + KIO3 + 6HCl === 6KCl + 3I2 +3H2O。此反应的氧化剂是 (填化学式),能观察到的明显现象是____________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南宁远一中、祁阳一中高二上第二次联考化学试卷(解析版) 题型:选择题
某温度时,一定压强下的密闭容器中发生反应:
aX(g)+bY(g)  cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
A. 平衡正移 B. (a+b)>(c+d)
C. Z的体积分数变小 D. X的转化率变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com