
 如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )
如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )| A、甲乙丙反应都属于氧化还原反应 |
| B、丙反应中的氧化剂是Na2O2,还原剂是H20 |
| C、丙反应中若消耗1molNa2O2,则转移2moL的电子 |
| D、甲乙丙反应后所得溶液的质量分数分别为ω1、ω2、ω3,则2ω1>ω2=ω3 |
| 1 |
| 2 |
| 1 |
| 2 |
| 4g |
| 100g+2.2g |
| 8g |
| 100g+6.2g |
| 8g |
| 100g+6.2g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
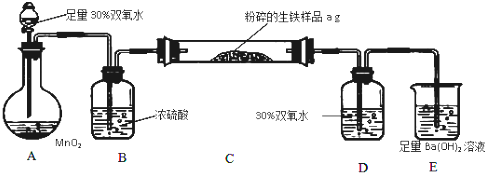
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

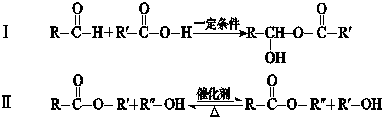
 RO-CH2-OR
RO-CH2-OR| a.D→E的反应类型为消去反应 | b.D能与Na、NaOH、NaHCO3反应 |
| c.Q是一种水溶性很好的高分子化合物 | d.G在酸性或碱性环境中均能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z为0.3mol/L |
| B、Y2为0.4mol/L |
| C、X2为0.2mol/L |
| D、Z为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
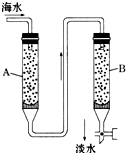 随着现代科学的不断发展,生产和生活所需淡水日益增多,甚至超过人类所能支配的淡水量,使地球上淡水资源发生危机,这就把海水淡化问题提到了科学家的面前.磺化媒(代表式NaR)是一种钠型离子交换树脂,它能使海水中的Ca2+、Mg2+交换除去.
随着现代科学的不断发展,生产和生活所需淡水日益增多,甚至超过人类所能支配的淡水量,使地球上淡水资源发生危机,这就把海水淡化问题提到了科学家的面前.磺化媒(代表式NaR)是一种钠型离子交换树脂,它能使海水中的Ca2+、Mg2+交换除去.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com