
����Ŀ��1��2-��������������Ϳ����������Ӽ���������������ɫҺ�壬�ܶ�2.18g/cm3���е�131.4��,�۵�9.79��,������ˮ�������ڴ����ѡ���ͪ���л��ܼ�����ʵ�����п�������ͼ��ʾװ���Ʊ�1��2-�������顣���з�Һ©����a��װ���Ҵ���Ũ����Ļ��Һ���Թ�d��װ��Һ��(���渲������ˮ)��

��д���пհ�:
��1������a������____________��
��2����д��a�з�����Ҫ��Ӧ�ķ���ʽ____________��
��3��ƿb��������____________����д����������ʱƿb�е�����____________��
��4���ᴿd�дֲ�Ʒ�ķ�����____________��
��5��ijѧ��������ʵ��ʱ��ʹ��һ������Һ�壬����ȫ����ɫʱ���������Ҵ���Ũ������Һ����������������³������ࡣ���װ�õ�������û�����⣬�Է�������ܵ�ԭ��____________��
���𰸡� ������ƿ CH3CH2OH![]() CH2=CH2+H2O ���Է�ֹ���������Լ��ʵ�����ʱ�Թ�d�Ƿ������� b��ˮ����½����������е�ˮ����������������� ���� ����ϩ����(��ͨ��Һ��)�ٶȹ���;��ʵ������У��Ҵ���Ũ����Ļ��Һû��Ѹ�ٴﵽ170��(�������²��������)(���һ������)
CH2=CH2+H2O ���Է�ֹ���������Լ��ʵ�����ʱ�Թ�d�Ƿ������� b��ˮ����½����������е�ˮ����������������� ���� ����ϩ����(��ͨ��Һ��)�ٶȹ���;��ʵ������У��Ҵ���Ũ����Ļ��Һû��Ѹ�ٴﵽ170��(�������²��������)(���һ������)
��������������Ҫ�������ʵ�����Ʊ��Ʊ�1��2-�������鷽�������ۡ�
��1������a�����ƣ�������ƿ��
��2��a����Ҫ������ϩ��������Ҫ��Ӧ�Ļ�ѧ����ʽ��CH3CH2OH![]() CH2=CH2+H2O��
CH2=CH2+H2O��
��3��ƿb�������п��Է�ֹ���������Լ��ʵ�����ʱ�Թ�d�Ƿ�����������������ʱƿb�е�������b��ˮ����½����������е�ˮ�������������������
��4��Һ̬���ܻ����һ����������ķ������룬�ᴿd�дֲ�Ʒ�ķ�����������
��5�����ܵ�ԭ��������ϩ����(��ͨ��Һ��)�ٶȹ�������ʵ������У��Ҵ���Ũ����Ļ��Һû��Ѹ�ٴﵽ170��(����²���)��


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ǧ����Ϊ��Դ��ʯīΪ�缫���CuSO4��Һ��װ������ͼ����һ��ʱ���Y�缫����6.4 g��ɫ����������ֹͣ��⡣����˵����ȷ����

A. aΪǦ���صĸ���
B. �������У�Ǧ���صĸ�������30.3g
C. ������ʱ�������Һ��������8g
D. Ǧ���ع���ʱ�����缫��ӦʽΪ��PbSO4+2e����Pb+SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������˵������һ�ּ���Һ��һ������Һ��Ϸ�Ӧ����֮һ��ǿ�������ʣ�����������Һ��Ϸ�Ӧ����Һ�����Լ���������ȷ�о�����֤���ڵ��� ( )
A.ֻ�Т�B.�ٺ͢�C.ֻ�Т�D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0��10mol��L��1NaOH��Һ�ֱ�ζ�20��00mLŨ�Ⱦ�Ϊ0��10 mol��L��1CH3COOH
��Һ��HCN��Һ���õζ���������ͼ������˵����ȷ����

A. �����͵�����ʾ��Һ�У�c��CH3COO������c��CN����
B. �����͵�����ʾ��Һ�У�c��Na������c��OH������c��CH3COO������c��H����
C. �����͵�����ʾ��Һ�У�c��CH3COO������c��CN������c��HCN����c��CH3COOH��
D. �����͵�����ʾ��Һ�ж��У�c��CH3COO������c��OH������c��CH3COOH����c��H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£��ܱ������з�����ӦM(g)![]() N(g),��Ӧ�����е������仯��ͼ������1��ʾ������˵���������
N(g),��Ӧ�����е������仯��ͼ������1��ʾ������˵���������

A. �÷�Ӧ����Ӧ���Ϊ(E3-E2)kJmol-1
B. �÷�Ӧ�ķ�Ӧ��Ϊ(E1-E2) kJmol-1
C. ����II��ʾ�����������䣬�����¶�ʱ�������仯
D. ����III��ʾ�����������䣬�������ʱ�������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2���ȶ����ֽ⣬Fe3+��Cu2+�ȶ���ֽ�������ã�Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч����ij��ѧ�о�С��ͬѧ�ֱ������ͼ1��ͼ2����ʵ��װ�ã� 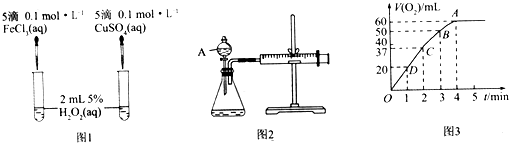
��1��������ͼ1ʵ�飬��ͨ���۲�������ݵĿ������ԱȽϵó����ۣ���ͬѧ�����FeCl3��ΪFe2��SO4��3��Ϊ�������������� �� д��H2O2�ڶ������̴������·�����Ӧ�Ļ�ѧ����ʽ�� �� ������ͼ2ʵ��ɽ��ж���������ͼ������A������Ϊ �� ʵ��ʱ��������40mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԣ�ʵ���л���Ҫ������������ ��
��2����0.1mol MnO2��ĩ����50mL H2O2��Һ�У��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ3��ʾ�����ͷ�Ӧ���ʱ仯��ԭ�� �� H2O2��ʼ���ʵ���Ũ��Ϊ��������λ��Ч���֣���
��3��Ϊ�˼���ͬѧ�Ƕ�Ӱ�췴Ӧ�������ص���ʶ����ʦ��ͬѧ�������ʵ�飺
������ʵ��װ�õ���ƿ�ڼ���6.5gп����ͨ����Һ©������40mL 2.5molL��1�����ᣬ10sʱ�ռ���������H2�����Ϊ44.8mL����״�������������ʾ10s�ڸ÷�Ӧ������ΪmolL��1s��1�����跴Ӧǰ����Һ��������䣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ�еμ�ϡ�������ɰ�ɫ�����������μ�ϡ���ᣬ�����ܽ����
A. Na2SiO3 B. BaCl2 C. FeCl3 D. NaAlO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С���о���������������ʱ���ı�ijһ�����Ի�ѧƽ���Ӱ�죬�õ����±仯����(ͼ��p��ʾѹǿ��T��ʾ�¶ȣ�n��ʾ���ʵ���)��


�������Ϲ����жϣ����н�����ȷ����(����)
A. ��Ӧ������H>0��p2>p1
B. ��Ӧ������H<0��T1>T2
C. ��Ӧ������H>0��T2>T1������H<0��T2<T1
D. ��Ӧ������H<0��T2>T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ں����ø�ѹ������ػ����Ϸ�չ������һ�ֽ����⻯�������(MHNi���)�������й�˵������ȷ����

A. �ŵ�ʱ������ӦΪNiOOH��H2O��e����Ni(OH)2��OH��
B. ��صĵ��Һ��ΪKOH��Һ
C. ���ʱ������ӦΪMH��OH����H2O��M��e��
D. MH��һ�ഢ����ϣ������ܶ�Խ��ص������ܶ�Խ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com