
CH4在一定条件下反应可以生成C2H4、C2H6(水和其他反应产物忽略不计)。取一定量CH4经反应后得到的混合气体,它在标准状况下的密度为![]() ,已知反应中CH4消耗了20%,计算混合气体中C2H4的体积分数。
,已知反应中CH4消耗了20%,计算混合气体中C2H4的体积分数。
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:阅读理解
 KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.

| 0.082 |
| 0.06×0.182 |
| 0.082 |
| 0.06×0.182 |
查看答案和解析>>
科目:高中化学 来源: 题型:
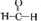
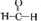
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高一4月月考化学试卷(解析版) 题型:填空题
据新华社2009年5月9日电, 国务院总理温家宝主持召开国务院常务会议,会上通过了我国2009年将投入大量资金发展新能源汽车,支持节能、环保、安全等关键技术开发,为我国社会经济可持续发展打下良好基础,为今后改善环境、提升民众的生活质量具有极为重要的意义。请回答下列问题:
(1)氢能是理想的清洁能源,也是氢氧燃料电池的必不可少的物质。请回答下列问题。
①下列说法不正确的是 。
A.太阳光催化分解水制氢比电解水制氢更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池负极电极反应相同
D.氢氧燃料电池正极获得8mol电子,负极需要8g气体
②利用MnFe2O4为催化剂,通过两步反应使水分解制氢气,第一步反反应为:
MnFe2O4 MnFe2O4-X+(X/2)O2
MnFe2O4-X+(X/2)O2
则第二步反应的化学方程式为 (条件不写)。
③一种新能源汽车,使用了以碳纳米管为储氢介质的燃料电池,电池原理如右图,该电池的电解质为6mol/LKOH溶液,下列说法不正确的是 。

A.放电过程中整个体系内KOH浓度不变
B.放电时负极附近pH减小
C.放电时电池正极的电极反应为:NiO(OH)+H2O+e—=Ni(OH)2+OH—
D.放电时,电池反应为2H2+O2→2H2O
(2)热值指在一定条件下每克物质完全燃烧所放出的热量(燃烧产物在该条件下是一种较为稳定的状态),下表是几种物质在常温常压下的热值数据。已知:管道煤气(47g/m3H2、625g/m3CO)价格为1.00元/m3,天然气(714g/m3CH4)的价格为2.50元/m3。
|
物质 |
H2 |
CO |
CH4 |
|
热值/kJ·g–1 |
143 |
10 |
56 |
①根据以上热值数据, 是最理想的燃料。
②家庭使用管道煤气和天然气, 更经济合算。
③表示CO燃烧热的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某化学兴趣小组在做《浓度对化学反应速率的影响》实验时发现,草酸溶液与高锰酸钾溶液反应时,溶液褪色先慢后快。为了探究此反应速率由小变大的原因,甲同学做了如下实验。
(1)0.10mol/L H2C2O4溶液的配制:
实验室欲配制80mL 0.10mol/L H2C2O4 溶液,需要称取草酸晶体(H2C2O4·2H2O g(精确到0.1g);实验中需要用到的玻璃仪器除了玻璃棒、胶头滴管、量筒外还有: 。(填代号)
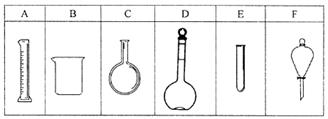
(2)反应速率变化的探究
| 1号试管 | 2号试管 | |
| 所加试剂 | 2mL0.10mol/L H2C2O4 溶液, 几滴稀硫酸,4mL0.010mol/L 的KMnO4溶液 | 2mL0.10mol/L H2C2O4 溶液,几 滴稀硫酸,4mL0.010mol/L的 KMnO4溶液,少量MnSO4固体。 |
| 褪色时间 | 31秒 | 4秒 |
①H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为 。
②甲同学能够得出结论 。
(3)在一定条件下,容积为100 L密闭容器中发生反应:CH4(g)+H20(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
 ΔH>0,将1.O molCH4和2.O mol H 20(g)通入该密闭容器,10 min时有O.1 mol CO生成,则10 min内该反应的平均速率ν(H2) 。
ΔH>0,将1.O molCH4和2.O mol H 20(g)通入该密闭容器,10 min时有O.1 mol CO生成,则10 min内该反应的平均速率ν(H2) 。
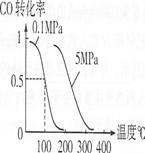
(4)在压强为O.1 MPa条件下,容积为V L某密闭容器中amol CO与2amol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
①该反应的AH O(填“<”、“>”或“=”)。
②100℃时该反应的平衡常数K (用含n、V的代数式表示)。
③在其它条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”),平衡常数 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年重庆市垫江实验中学高二(上)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com