
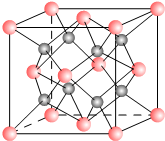
 一种离子晶体的晶胞如右图.其中阳离子A以
一种离子晶体的晶胞如右图.其中阳离子A以分析 (1)利用均摊法计算离子数目;
(2)根据离子的化合价及与其电子层结构相同的惰性气体元素判断该离子元素,从而写出其化学式;
(3)阳离子周围距离最近的阴离子数为8,阴离子周围距离最近的阳离子数是4;
(4)根据A离子的半径金属晶胞的边长,再利用体积公式计算.
解答 解:(1)每个晶胞中含A离子的数目=8×$\frac{1}{8}$=4,含B离子数目为8,
故答案为:4;8;
(2)通过(1)知,该物质的化学式为:AB2,A是金属阳离子,则A的化合价是+2价,若A的核外电子排布与Ar相同,则A是Ca元素,B的化合价是-1价,且B的电子排布与Ne相同,则B是F元素,则该离子化合物的化学式是CaF2,
故答案为:CaF2;
(3)阳离子周围距离最近的阴离子数为8,阴离子周围距离最近的阳离子数是4,
故答案为:8;4;
(4)该晶胞中正方形对角线的长度=4rm,则该晶胞的边长=2$\sqrt{2}$rm,则该晶胞的体积=(2$\sqrt{2}$rm)3=16$\sqrt{2}$r3 m3,
故答案为:16$\sqrt{2}$r3 .
点评 本题考查了晶胞的有关计算,难点是配位数、晶胞体积的计算,注意晶胞边长不等于A离子直径,为易错点.


科目:高中化学 来源: 题型:解答题
 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
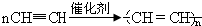 .
.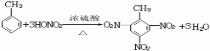 ;该物质的一氯代物有4种.
;该物质的一氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | 阳极 | 阴极 | 甲溶液 | 物质乙 |
| A | Ag | Cu | AgNO3溶液 | AgNO3固体 |
| B | C | Cu | CuSO4溶液 | Cu(OH)2 |
| C | Pt | Pt | NaOH溶液 | NaOH固体 |
| D | C | Fe | NaCl溶液 | HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (I)由短周期元素构成的A~E五种物质中都含有同一种元素,B为单质.
(I)由短周期元素构成的A~E五种物质中都含有同一种元素,B为单质.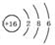 ,A既能与强酸又能与强碱反应,且都能产生气体,请画出A的电子式为
,A既能与强酸又能与强碱反应,且都能产生气体,请画出A的电子式为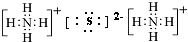 或
或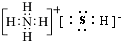 .
.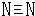
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用白糖的主要成分是蔗糖 | |
| B. | 油脂、淀粉和蛋白质都是高分子化合物 | |
| C. | 油脂不能使溴水褪色 | |
| D. | 乙酸乙酯和食用油都可以水解生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com