
| A. | 苯丙醇胺的结构简式为: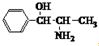 ,其分子中有2个手性碳原子 ,其分子中有2个手性碳原子 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | 完全由非金属元素形成的化合物中也可能含有离子键 | |
| D. | CO2、SiO2都是分子晶体 |
分析 A.手性碳原子是碳原子上连接4个不同的原子或原子团;
B.NH4+中氮原子提供孤电子对,氢原子提供空轨道,从而形成配位键,[Cu(NH3)4]2+中铜原子提供空轨道,氮原子提供孤电子对,所以形成配位键;
C.铵盐是由非金属元素构成的离子化合物;
D.二氧化硅属于原子晶体.
解答 解:A.手性碳原子是碳原子上连接4个不同的原子或原子团,苯丙醇胺的结构简式为: ,分子中与苯环相连的C原子以及与该原子相连的C原子为手性碳原子,所以该分子有2个手性碳原子,故A正确;
,分子中与苯环相连的C原子以及与该原子相连的C原子为手性碳原子,所以该分子有2个手性碳原子,故A正确;
B.NH4+中氮原子提供孤电子对,氢原子提供空轨道,从而形成配位键,[Cu(NH3)4]2+中铜原子提供空轨道,氮原子提供孤电子对,所以形成配位键,故B正确;
C.铵盐是由非金属元素构成的离子化合物,铵盐中含有离子键,所以完全由非金属元素形成的化合物中也可能含有离子键,故C正确;
D.CO2属于分子晶体,SiO2中不存在分子,属于原子晶体,故D错误;
故选D.
点评 本题考查了物质结构和性质,题目难度不大,明确手性原子特点、晶体类型的判断方法、配位键的判断即可解答,难点是手性碳原子和配位键的判断.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大N2的浓度可使该反应的反应速率加快 | |
| B. | 升高温度,该反应的反应速率加快 | |
| C. | 将1 mol N2和3 mol H2混合进行反应,反应完成时得到2 mol NH3 | |
| D. | 单位时间内生成1 mol N2,同时消耗3 mol H2,说明该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:3 | B. | 3:1 | C. | 1:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医学上,血液透析是利用了胶体的渗析原理 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 铜的金属性比铝弱,可以用铜罐贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com