
【题目】某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2).为了制取Cl2和探究氯及其化合物的相关性质,进行如下实验. 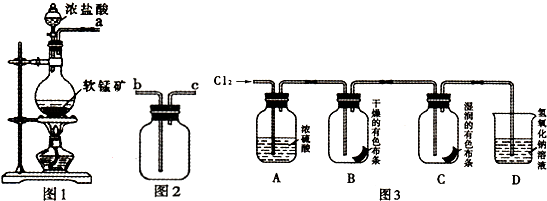
【查阅资料】MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
【制取气体】
(1)取适量矿样置于烧瓶中,加入足量浓盐酸并加热,充分反应后烧瓶中残留的固体是 .
(2)收集氯气应将图1导管的a接口与图2导管的接口连接(填“b”或“c).
(3)若生成标准状况下11.2L Cl2 , 则参加反应的MnO2的物质的量为 mol.
(4)【实验探究】 把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟.反应的化学方程是 .
(5)按图3进行实验,观察到B中的有色布条不褪色,C中的有色布条褪色.由此得出的结论 .
(6)写出C中反应的化学方程式: .
(7)【联系实际】 某氯碱工厂的氯气管道发生泄漏,以下采取的措施正确的是 (填序号).
A.将人群向高处疏散
B.将人群向低处疏散
C.关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位
D.关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位.
【答案】
(1)石英(SiO2)
(2)b
(3)0.5
(4)2Fe+3Cl2![]() 2FeCl3
2FeCl3
(5)氯气无漂白性,起漂白性的物质是HClO
(6)Cl2+H2O?HCl+HClO
(7)AC
【解析】解:(1)软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2),加入浓盐酸加热反应生成氯化锰,氯气和水,MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,生成的氯化锰溶于水,样品中的二氧化硅不溶,所以烧瓶中残留的固体是二氧化硅固体;
MnCl2+Cl2↑+2H2O,生成的氯化锰溶于水,样品中的二氧化硅不溶,所以烧瓶中残留的固体是二氧化硅固体;
故答案为:石英(SiO2);(2)氯气的密度大于空气的密度,收集氯气的方法是向上排气法收集,导气管长进短处,图1导管的a接口与图2的导管的b接口连接;
故答案为:b;(3)若生成标准状况下11.2LCl2,物质的量为0.5mol,化学反应MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,则参加反应的MnO2的物质的量为0.5mol;
MnCl2+Cl2↑+2H2O,则参加反应的MnO2的物质的量为0.5mol;
故答案为:0.5;(4)把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟,是铁在氯气中燃烧生成氯化铁的反应过程,反应的化学方程式为:2Fe+3Cl2 ![]() 2FeCl3;
2FeCl3;
故答案为:2Fe+3Cl2 ![]() 2FeCl3;(5)按图3进行实验,观察到B中干燥的有色布条不褪色,说明氯气无漂白性,C中湿润的有色布条褪色,氯气和水反应生成的次氯酸具有漂白性;
2FeCl3;(5)按图3进行实验,观察到B中干燥的有色布条不褪色,说明氯气无漂白性,C中湿润的有色布条褪色,氯气和水反应生成的次氯酸具有漂白性;
故答案为:氯气无漂白性,起漂白性的物质是HClO;(6)氯气和水反应的化学方程式为:Cl2+H2OHCl+HClO;
故答案为:Cl2+H2OHCl+HClO;(7)A、氯气的密度大于空气的密度,所以和空气混合时,氯气在下方,空气在上方,所以发生氯气泄漏时,不能向地势低的地方撤离,应向高处疏散,故A正确;
B、氯气的密度大于空气的密度,所以和空气混合时,氯气在下方,空气在上方,所以发生氯气泄漏时,不能向地势低的地方撤离,应向高处疏散,故B错误;
C、氯气能和水反应生成酸,所以氯气能和碱反应生成盐和水,关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位,避免氯气逸出,故C正确;
D、氯气水中的溶解性较小,关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位,不能很好的吸收氯气,故D错误;
故选AC.
(1)软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2),加入浓盐酸加热反应生成氯化锰,氯气和水,样品中的二氧化硅不溶;(2)依据氯气的密度大于空气的密度分析;(3)依据化学方程式计算得到;(4)铁在氯气中燃烧生成红褐色烟氯化铁固体小颗粒;(5)依据氯气无漂白性,氯气和水反应生成的次氯酸具有漂白性分析;(6)氯气和水反应生成次氯酸和氯化氢;(7)氯气是黄绿色有毒气体,密度比空气大,且氯气的溶解性较小,1体积的水能溶解2体积的氯气,氯气能和水反应生成酸,所以氯气能和碱反应生成盐和水.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的佛点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
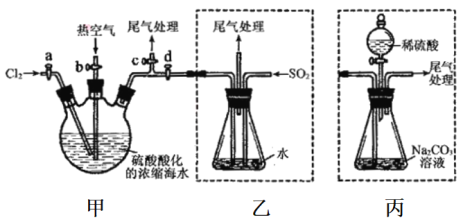
①连接甲与乙,关闭活案b、d,打开活案a、c,向甲中缓慢通入Cl2至反应结束。
②关闭a、c,打开b、d,向甲中鼓入足量热空气。
③进行步骤②的同时,向乙中通入足量SO2。
④关闭b,打开a,再通过甲向乙中级慢通入足量Cl2。
⑤将乙中所得液体进行蒸馏,收集液溴。
请回答:
(1)步骤②中鼓入热空气作用为____________。
(2)步骤③中发生的主要反应的离子方程式为___________。
(3)此实验中尾气可用____(填选项字母)吸收处理。
A.水 B.饱和Na2CO3溶液 C.NaOH溶液 D.饱和NaCl溶液
(4)若直接连接甲与丙进行步骤①和②,充分反应后,向维形瓶中满加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,丙中反应生成了NaBrO3等,该反应的化学方程式为______。
(5)与乙装置相比,采用丙装置的优点为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积固定的某密闭容器中发生反应N2+3H2![]() 2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
A. 用NH3表示的化学反应速率为0.1 mol·L-1·s-1
B. 使用合适的催化剂,可以加快该反应的速率
C. 增加H2的浓度或降低温度都会加快该反应速率
D. 反应足够长时间,N2、H2中至少有一种物质浓度降为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用工厂的铁和铜混合屑末,进行如下实验: 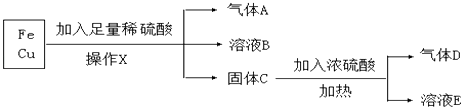
(1)操作X的名称是;
(2)气体D是;
(3)A与氧化铜加热反应生成铜和水,反应中固体的颜色变化是;A作(填“氧化剂”或“还原剂”);
(4)溶液B中的金属阳离子是 , 溶液E中阴离子除了OH﹣外还有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z原子序数之和为36,Y、Z在同一周期,X与Z在同一主族,X原子最外层电子数是Y原子最外层电子数的3倍。
(1)写出下列元素符号:
X ,Y ,Z
(2)X与Y两元素可形成化合物属 (“离子”或“共价 ”)化合物。
(3)写出X与Z所形成的化合物的化学式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示。下列说法不正确的是( )
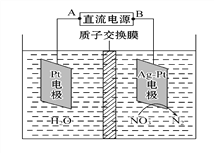
A. A为电源的正极
B. 溶液中H+从阳极向阴极迁移
C. 电解过程中,每转移2 mol电子,则左侧电极就产生32gO2
D. Ag-Pt电极的电极反应式为2NO3-+12H++10e- = N2↑+ 6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com