
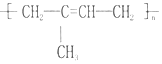 的名称聚2-甲基-1,3-丁二烯,其单体的结构简式CH2═C(CH3)CH═CH2.
的名称聚2-甲基-1,3-丁二烯,其单体的结构简式CH2═C(CH3)CH═CH2.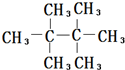 .
. .
.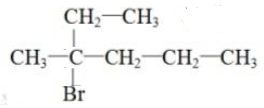 .
. 分析 (1)石油通过裂化和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平,乙烯可生产聚乙烯塑料;
(2)首先要根据高聚物的结构简式判断高聚物是加聚产物还是缩聚产物,然后根据推断单体的方法作出判断;
(3)2,2,3,3-四甲基丁烷不能由烯烃加成得到;
(4)有机物C8H8的一种同分异构体1H--NMR谱中只有一个信号,只有1种氢,能使溴水褪色,说明含有碳碳不饱和键,据此分析;
(5)与氢氧化钠的乙醇溶液共热可得到三种烯烃,说明该卤代烃分子中与溴原子连接的碳上含有三种不同的烃基.
解答 解:(1)乙烯的产量作为衡量一个国家石油化学工业发展水平的标志,乙烯发生加聚反应得到聚乙烯塑料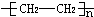 ,
,
故答案为:衡量一个国家石油化学工业发展水平;生产聚乙烯塑料;
(2) 链节中主碳链为4个碳原子,含有碳碳双键结构,单体为一种,从主链中间断开后,再分别将两个半键闭合即得单体为:2-甲基-1,3-丁二烯,所以该高分子名称为聚2-甲基-1,3-丁二烯,其单体的结构简式为:CH2═C(CH3)CH═CH2,
链节中主碳链为4个碳原子,含有碳碳双键结构,单体为一种,从主链中间断开后,再分别将两个半键闭合即得单体为:2-甲基-1,3-丁二烯,所以该高分子名称为聚2-甲基-1,3-丁二烯,其单体的结构简式为:CH2═C(CH3)CH═CH2,
故答案为:聚2-甲基-1,3-丁二烯;CH2═C(CH3)CH═CH2;
(3)乙烷中,六个氢原子被甲基取代,得到的物质为 ,不能由烯烃加成得到,
,不能由烯烃加成得到,
故答案为: ;
;
(4)有机物C8H8的一种同分异构体1H--NMR谱中只有一个信号,只有1种氢,能使溴水褪色,说明含有碳碳不饱和键,因结构对称,所以其结构为: ,
,
故答案为: ;
;
(5)与氢氧化钠的乙醇溶液共热可得到三种烯烃,说明该卤代烃分子中与溴原子连接的碳上含有三种不同的烃基,这种同分异构体的结构简式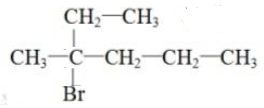 ,消去可生成:CH3C(CH2CH3)=CH2CH2CH3,CH2=C(CH2CH3)CH2CH2CH3、CH3C(CH2CH2CH3)=CHCH3,
,消去可生成:CH3C(CH2CH3)=CH2CH2CH3,CH2=C(CH2CH3)CH2CH2CH3、CH3C(CH2CH2CH3)=CHCH3,
故答案为: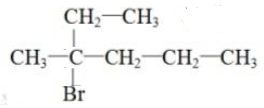 .
.
点评 本题考查有机物的官能团的结构与性质,注意根据有机物的结构和同分异构体的书写,较好的考查了学生分析推理能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
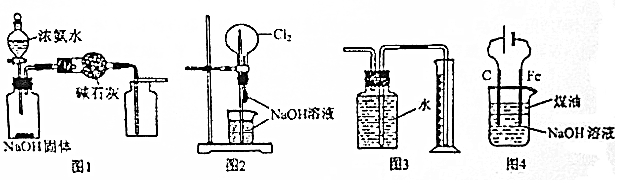
| A. | 图1装置可制取干燥纯净的NH3 | |
| B. | 图2装置可以完成“喷泉”实验 | |
| C. | 图3装置可测量Cu与浓硝酸反应产生气体的体积 | |
| D. | 图4装置可用于实验室制备Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该实验过程中要用到氧化剂 | |
| B. | 检验碘单质是否存在,可用碘化钾溶液 | |
| C. | 要萃取碘水中的碘,可以用汽油或酒精 | |
| D. | 利用如图所示装置不能分离食盐和晶体碘的混和物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li2NH中N的化合价是-1 | B. | 此法储氢和钢瓶储氢的原理相同 | ||
| C. | H+与H -的离子半径均比Li+大 | D. | 该反应中H2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验→分类(预测Br2的化学性质)→观察(得出Br2的物理性质)→比较并得出结论 | |
| B. | 分类(预测Br2的化学性质)→观察(得出Br2的物理性质)→实验→比较并得出结论 | |
| C. | 观察(得出Br2的物理性质)→实验→分类(预测Br2的化学性质)→比较并得出结论 | |
| D. | 观察(得出Br2的物理性质)→分类(预测Br2的化学性质)→实验→比较并得出结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z均属于短周期元素 | |
| B. | 离子半径X+>Y- | |
| C. | X、Y、Z三种元素只能形成化合物XYZ3 | |
| D. | Y的气态氢化物的热稳定性可能较强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
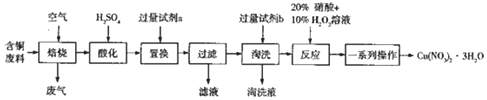
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化钡溶液中通入少量CO2 | |
| B. | 向饱和氢氧化钠溶液中加入钠单质 | |
| C. | 向饱和碳酸钠溶液中通入过量CO2 | |
| D. | 向NaHCO3溶液中加入过量澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
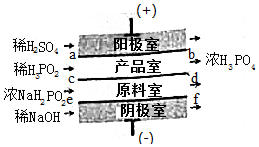 次磷酸(H3PO2)位一元酸,具有较强的还原性.可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴离子),下列说法描述错误的是( )
次磷酸(H3PO2)位一元酸,具有较强的还原性.可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴离子),下列说法描述错误的是( )| A. | 阳极室反应为:2H2O-4e-=O2↑+4H+ | |
| B. | ab,ef均为阳膜,cd为阴膜 | |
| C. | 若将稀H2SO4改为H3PO3,撤去ab膜,产品中总混有杂质的原因是:H3PO2在阳极放电而被氧化生成H3PO4 | |
| D. | 通电后产品室中的H+离子向原料室迁移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com