
【题目】25℃,向50mL 0.018mol/L AgNO3溶液中加入50mL 0.02mol/L 盐酸生成沉淀.已知:Ksp(AgCl)=1.8×10﹣10 , 则生成沉淀后的体系中c(Ag+)为( )
A.1.8×10﹣7mol/L
B.1.8×10﹣8 mol/L
C.1.8×10﹣9mol/L
D.1.8×10﹣10mol/L
 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】葛根大豆苷元(F)用于治疗高血压引起的头疼、突发性耳聋等症,其合成路线如图:
(1)化合物C中的含氧官能团有、(填官能团名称).
(2)已知:C→D为取代反应,其另一产物为H2O,写出X的结构简式: .
(3)反应E→F的反应类型是 .
(4)化合物A的一种同分异构体W属于芳香醇,写出W的结构简式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 在常温常压下,32 g 18O2中含有2NA个氧原子
B. 100 g 17%的氨水,溶液中含有的NH3分子数为NA
C. 50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D. 7.8gNa2O2中阴离子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿(主要成分:FeS2和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:
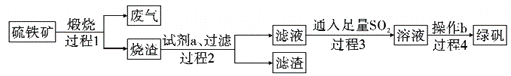
下列说法不正确的是( )
A. 过程1,废气中含SO2
B. 过程2,试剂a为稀硫酸
C. 过程3,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D. 过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转化的认识中不正确的是( )
A. 镁在空气中燃烧时,化学能不只转化为热能
B. H2→H+H的变化需要吸收能量
C. 凡需要持续加热才能发生的化学反应都是吸热反应
D. 原电池工作时,化学能全部转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液.实验室一般先称取一定质量的KMnO4晶体,配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对配制的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42﹣+2MnO4﹣+16H+═10CO2↑+2Mn2++8H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先配制浓度约为0.10molL﹣1的高锰酸钾溶液500mL.
步骤二:取0.02molL﹣1 的Na2C2O420.00mL放入锥形瓶中,并加稀硫酸酸化,用步骤一所配高锰酸钾溶液进行滴定.三次平行实验的数据记录在表中:
平行实验编号 | Na2C2O4溶液 | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
① | 20.00 | 0.00 | 21.18 |
② | 20.00 | 1.02 | 21.00 |
③ | 20.00 | 1.18 | 21.20 |
试回答下列问题:
(1)步骤一中要用到的主要玻璃仪器是除烧杯、玻璃棒外还需 .
(2)步骤二中滴定操作选用滴定管(填“酸式”或“碱式”)滴定终点的判断方法:
(3)下来滴定操作会导致测量结果偏高的是
A.滴定管滴定前有气泡,滴定后气泡消失
B.锥形瓶洗涤后没有干燥
C.滴定终点时,读数时俯视
D.滴定时锥形瓶中有液体溅出
E.一滴高锰酸钾溶液附在锥形瓶壁上未冲下
(4)从实验所得数据计算,KMnO4溶液的浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的NO2气体,且起始时体积相同.发生反应:2NO2(g)N2O4 (g)△H<0.一段时间后相继达到平衡状态.下列说法中正确的是( )
A.平衡时NO2体积分数:甲<乙
B.达到平衡所需时间,甲与乙相等
C.该反应的平衡常数表达式K=c(N2O4)/c(NO2)
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )

A. 溶液中一定不含CO32﹣,可能含有SO42-和NO3-
B. 溶液中n(NH4+)="0.2" mol
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+)︰n(Al3+)︰n(Mg2+)=1︰1︰1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com