
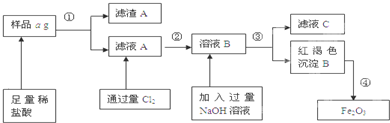
| ||
| ag |
| 7b |
| 10a |
| 7b |
| 10a |


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源:不详 题型:单选题
| A.该有机物含碳、氢、氧三种元素 |
| B.该化合物是乙烷 |
| C.该化合物分子中碳、氢原子个数之比是2:3 |
| D.该化合物分子中含2个碳原子,6个氢原子,但不能确定是否含氧元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 浓硫酸 |
| 加热 |
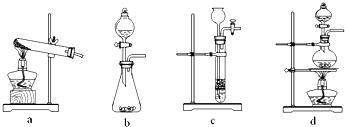
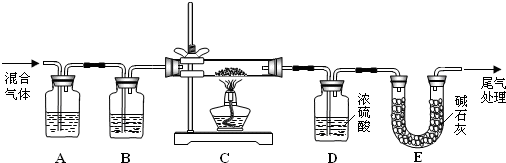
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0 

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 离子 | Al3+ | Fe3+ | Ni2+ |
| pH | 5.2 | 4.1 | 9.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com