
| A. | OH-、NO3-、K+、Na+ | B. | H+、Fe3+、SO42-、Cl- | ||
| C. | K+、Cu2+、Cl-、CO32- | D. | Al3+、Fe2+、NO3-、OH- |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
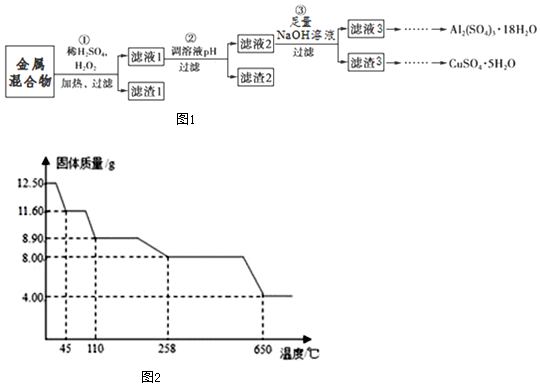
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉溶液中加入稀硫酸加热后,再用NaOH中和,并做银镜反应实验--检验淀粉是否水解 | |
| B. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热:检验混合物中是否含有甲醛 | |
| C. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| D. | 检验某溴乙烷中的溴元素可向其中加入AgNO3溶液,观察有无浅黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
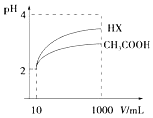 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5mol•L-1 | K1=4.4×10-7mol•L-1 K2=5.6×10-11mol•L-1 | 3.0×10-8 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗盐先通过除杂、精制得到饱和食盐水,然后电解得到氯气,最后和石灰乳反应制得漂白粉 | |
| B. | 苦卤酸化后通入氯气得到溴水,然后用热空气将其通入到SO2水溶液中,最后通入氯气后蒸馏得粗溴 | |
| C. | 干海带灼烧后加水浸取,然后加入H2O2得到碘水,最后通过萃取、分液、蒸馏得到碘单质 | |
| D. | 向海水中加入石灰乳得到Mg(OH)2,加入盐酸得到MgCl2溶液,最后电解该溶液得到镁单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com