
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

| Kw[Fe(OH)3] |
| C3(OH-) |
| Kw[Fe(OH)3] |
| C3(OH-) |
| 2.6×10-39 |
| (1×10-10)3 |
| 0.002mol×171g/mol |
| 0.36g |


科目:高中化学 来源: 题型:
| A、金属镁与稀盐酸反应:有气泡逸出:Mg+2H++2Cl-═MgCl2+H2↑ |
| B、NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
| C、碳酸钠溶液与盐酸反应:有气泡逸出:Na2CO3+2H+═2Na++CO2↑+H2O |
| D、氯化钡溶液与稀硫酸反应:有白色沉淀生成:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饮用酸性饮料 |
| B、在牙膏中添加适量的Ca2+离子 |
| C、少吃甜食 |
| D、在牙膏中加入氟化物添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可以根据PbI2和AgCl的Ksp的大小比较两者的溶解度 |
| B、常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大 |
| C、等物质的量浓度的CH3COONH4溶液和NH4HSO4溶液,前者的c(NH4+)小 |
| D、用惰性电极电解饱和NaCl溶液,若有1.0 mol电子转移,则理论生成1.0 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AgCl饱和溶液中加入NaCl固体,AgCl的Ksp增大 |
| B、AgCl不溶于水,溶液中没有Cl-和Ag+ |
| C、AgCl沉淀的生成和溶解仍在不断进行,但速率相等 |
| D、向AgCl饱和溶液中加入NaCl固体,没有AgCl产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中含有大量Mg2+、Al3+、Fe3+、Ag+、Ba2+等离子.试分析回答下列问题:
在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中含有大量Mg2+、Al3+、Fe3+、Ag+、Ba2+等离子.试分析回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
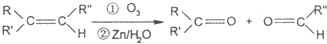
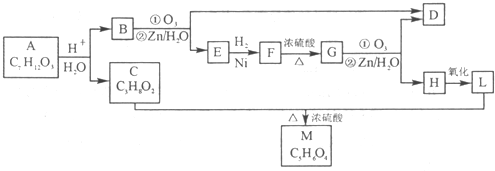
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质的量 | 0(min) | 10(min) | 20(min) | 30(min) | 40(min) | 50(min) | 60(min) |
| NO | 1 | 0.8 | 0.58 | 0.4 | 0.4 | 0.32 | 0.32 |
| N2 | 0 | 0.1 | 0.21 | 0.3 | 0.3 | 0.34 | 0.34 |
| CO2 | 0 | 0.1 | 0.21 | 0.3 | 0.3 | 0.17 | 0.17 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com