
| 314.624KJ |
| 196.64KJ |
| 3.2mol |
| 4mol |
| c(PCl3)c(Cl2) |
| c(PCl5) |
| 2mol |
| 10L |
| c(PCl3)c(Cl2) |
| c(PCl5) |
| 0.15×0.15 |
| 0.05 |
| c(PCl3)c(Cl2) |
| c(PCl5) |
| m |
| M |
| 1800g |
| 18g/mol |


科目:高中化学 来源: 题型:
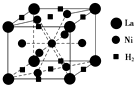 目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.
目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KMnO4酸性溶液既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 |
| B、在混有乙酸的乙酸乙酯中加入NaOH溶液可以达到除杂的目的 |
| C、丙烯的结构简式可以表示为CH3CHCH2 |
| D、CH2Cl2是纯净物说明甲烷是四面体结构而不是正方形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用盖斯定律可计算某些难以直接测量的反应焓变 |
| B、如果一个化学方程式通过其他几个化学方程式相加减而得到,则该反应的焓变可由相关的化学方程式的焓变相加减而得到 |
| C、对于放热反应,放出的热量越多,焓变越小 |
| D、当同一个化学反应以不同的过程完成时,反应的焓变是不同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM 2.5(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶而对人体产生危害 |
| B、明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
| C、地沟油对身体有害不能用作食用油,但可以在循环经济中发挥作用 |
D、塑化剂的基本结构为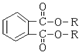 ,因此可以水解成对人体无害的物质 ,因此可以水解成对人体无害的物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com