
【题目】常见铅蓄电池是二次电池,其电极材料分别为Pb和PbO2,电解液为稀H2SO4溶液,工作时的总反应式为Pb +PbO2 + 2H2SO4 ![]() 2PbSO4 +2H2O。请依据上述情况判断:
2PbSO4 +2H2O。请依据上述情况判断:
(1)铅蓄电池的负极材料是________________。
(2)请依据两极材料和总反应,写出放电时正极反应是______________。
(3)请依据总反应式和正极反应式,写出放电时负极反应是________________________。(4)放电时,电解质溶液中阴离子移向______极;电流方向从______极流向______极。
(5)放电时,电解质溶液的酸性_________(填“增强”、“减弱”或“不变”)。
【答案】 Pb PbO2+2e-+4H++SO42-=PbSO4+2H2O Pb-2e-+SO42-= PbSO4 负极 正 负 减弱
【解析】(1)根据电池总反应式可知,Pb元素化合价由0价、+4价变为+2价,因为在原电池中负极发生失电子化合价升高的氧化反应,所以Pb为负极材料。
(2)放电时,正极上PbO2得电子,同时与H2SO4反应生成PbSO4和水,电极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O。
(3)放电时,负极Pb失电子发生氧化反应,同时与SO42-反应生成PbSO4,电极反应式为:Pb-2e-+SO42-= PbSO4。
(4)放电时,负极Pb失电子,电子从负极沿外电路流向正极,电流方向与电子运动方向相反,故电流从正极流向负极;阳离子与电流方向形成闭合,阴离子与电子方向形成闭合,所以电解质溶液中阳离子向正极移动、阴离子向负极移动。
(5)放电时,H2SO4参加反应导致溶液中c(H+)降低,故电解质溶液的酸性减弱。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. pH=1的溶液中: Fe2+,NO3-,SO42-,Na+
B. 由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+,K+,Cl-,HCO3-
C.  =1012的溶液中:NH4+,Al3+,NO3-,Cl-
=1012的溶液中:NH4+,Al3+,NO3-,Cl-
D. c(Fe2+) =0.1 mol·L-1的溶液中:K+,ClO-,SO42-,SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物结构、性质相关的叙述错误的是 ( )
A.苯酚分子中含有羟基,不与NaHCO3溶液反应生成CO2
B.溴乙烷含溴原子,在氢氧化钠的乙醇溶液共热下发生取代反应
C.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验过程(固定、加热及盛接仪器略)证明了海带中存在碘元素:
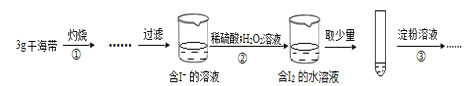
下列说法不正确的是
A. 步骤①需要将干海带放入坩埚中灼烧
B. 步骤②反应的离子方程式为:2I- +2H++H2O2 =I2+2H2O
C. 步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素
D. 若步骤②仅滴加稀硫酸后放置一会儿,步骤③操作后,试管中溶液颜色无明显变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若电解5min时,铜电极质量增加21.6g。
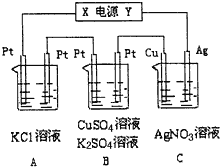
(1)电源电极Y名称为__________(填“正极”或“负极” )。
(2)电解池中溶液的pH变化:A_________,B________(填“增大”、“减小”或“不变”)。
(3)A中发生反应的离子方程式为:_________________,若A中KCl溶液的体积也是200mL,电解后溶液OH-的浓度等于_______。
(4)B中阳极的电极反应式为____________________;若通电5min时B中共收集2.24L气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度约为______。
(5)若将C装置单独取出,导线连接铜、银后,请写出负极的电极反应式____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《开宝本草》中记载了中药材铁华粉的制作方法:“取钢煅作叶如笏或团,平面磨错令光净,以盐水洒之,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣。”中药材铁华粉是( )
A.氧化铁B.氯化亚铁C.氯化铁D.醋酸亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素X、Y,已知X的质子数为a,X2+比Y2-核外少8个电子,若Y原子的质量数为b,则Y原子核内中子数为( )
A. b-a-4 B. b-a-8 C. b+a+8 D. b-a-12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序是 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) .
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com