
8![]() +5Cu2S+44H+
+5Cu2S+44H+![]() 10Cu2++5SO2+8Mn2++22H2O
10Cu2++5SO2+8Mn2++22H2O
6![]() +5CuS+28H+
+5CuS+28H+![]() 5Cu2++5SO2+6Mn2++14H2O
5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
□![]() +□Fe2++□H+
+□Fe2++□H+![]() □Mn2++□Fe3++□H2O
□Mn2++□Fe3++□H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_____________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=
(4)混合物中Cu2S的质量分数为_____________。
解析:方程式可用化合价升降法、观察法配平。与(NH4)2Fe(SO4)2反应的KMnO4即为与混合物反应剩余的,依据(1)所配平的反应方程式![]() +5Fe2++8H+
+5Fe2++8H+![]() Mn2++5Fe3++4H2O,可以看出反应的KMnO4与(NH4)2Fe(SO4)2的物质的量之比为1∶5,故剩余的KMnO4为0.007 mol。
Mn2++5Fe3++4H2O,可以看出反应的KMnO4与(NH4)2Fe(SO4)2的物质的量之比为1∶5,故剩余的KMnO4为0.007 mol。
由(2)可知与混合物反应的高锰酸钾的物质的量为:
设原混合物中含Cu2S的质量为x,CuS的质量为y。
8KMnO4—5Cu2S 6KMnO4—5CuS
x/160 y/96

解得x=0.8,故Cu2S的质量分数为40%。
答案:(1)1 5 8 1 5 4 (2)0.007 (3)19.6 (4)40%


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年重庆市高三上学期12月月考理综化学试卷(解析版) 题型:填空题
合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产。
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质的浓度(mol·L﹣1)如下表:
|
|
0 min |
l min |
2 min |
3 min |
4 min |
|
N2 |
1.500 |
1.400 |
1.200 |
c1 |
c1 |
|
H2 |
4.500 |
4.200 |
3.600 |
c2 |
c2 |
|
NH3 |
0 |
0.200 |
0.600 |
c3 |
c3 |
根据表中数据得知0 min~2 min内N2的平均反应速率是_______,若3 min末N2的转化率为a,则此时H2的转化率为_______ (用含a的代数式表示)。
(2)今对合成氨反应进行如下研究:在容积均为10 L的a、b、c三个相同密闭容器中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如图所示。则下列说法正确的是_______。

A.a、b、C三容器5 min时的正反应速率大小为:b>a>c
B.达到平衡时,a、b、c中N2转化率为a>b>c
C.5min时,a、b、c三容器中的反应均可能达到平衡状态。
D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压
(3)已知:N2(g)+O2(g)=2NO(g): △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=﹣905 kJ/mol
2H2(g)+O2(g)=2H2O(g); △H=﹣483.6 kJ/mol
则在该条件下,氨合成塔中所发生反应的热化学方程式为:____________________________;
(4)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,写出该反应的离子方程式:_________________________________________;
(5)取200 mL的硝酸恰好与32 g Cu2S完全反应,已知硝酸被还原成等物质的量的NO和NO2,另外还有CuSO4和Cu(NO3)2生成,则所得工业硝酸的浓度是_______mol·L﹣1。
查看答案和解析>>
科目:高中化学 来源:2014届河北省高三上学期二调考试化学试卷(解析版) 题型:填空题
铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是
。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是
。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃-60℃的两个原因除了加快反应速率外,还有 。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式 。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO, 其猜想可用化学方程式表示为:
Cu + H2SO4
②乙同学认为:黑色固体除CuO外还可能含有Cu2S和CuS.其理由可能是 (填字母)
a.Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价上升与S的化合价下降有多种可能
(4)现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式 。若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:填空题
某实验小组用工业废弃固体(主要成分为Cu2S和Fe2O3)制备有关物质,整个流程如下图所示。请回答:
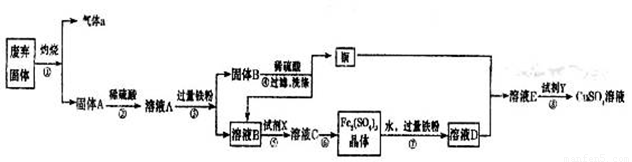
(1)气体a的化学式为 。
(2)溶液B加入硫酸酸化后再加入适宜氧化剂X得到溶液C,写出该反应的离子方程式 。
(3)制备硫酸铜溶液。常温下,O2、铜粉和稀硫酸三者在一起,几乎不反应,当加入溶液D后,随即生成硫酸铜。经理阅资料发现FeSO4对铜的氧化起催化作用。
A.第一步反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,则第二步反应的郭子方程式为 。
B.⑦操作中,配制Fe2(SO4)3溶液时应注意 。
(4)操作⑧的目的是得到较纯的硫酸铜溶液。加入适宜试剂Y调节pH至铁元素全部沉淀(离子浓度小于10-5mol/L),然后再过滤,浓缩、结晶等,则pH至少调节为_____。
已知:Ksp[Cu(OH)2]≈1×10-22,Ksp[Fe(OH)2] ≈1×10-16,Ksp[Fe(OH)3] ≈1×10-38
(5)科学家发现纳米级的Cu2O在太阳光照射下可以催化分解水。
A.一定温度下,在2L密闭容器中加入纳米级Cu2O,通入2mol水蒸气,发生如下反应:
2H2O(g)=2H2(g)+O2(g) △H=+484kJ/mol
20min末测得n(O2)=0.16mol,则这段时间的反应速率υ(H2)=_________;该温度下,此反应的平衡常数表达式K=___________________。
B.已知:2Cu2O(s)+O2(g)=4CuO(s) △H=-292kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
请写出炭粉还原CuO(s)制备Cu2O(s)的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用![]() 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
A.1mol Na2O2固体中含离子总数为2![]()
B.0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 ![]()
C.8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1![]()
D.1 mol FeCl3制成胶体,所得胶体的粒子数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com