
【题目】某有机物含C、H、O、N四种元素,其3D模型如图所示。下列有关该有机物的说法正确的是
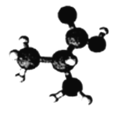
A.常温常压下呈气态B.分子式为C3H7O2N
C.与甘氨酸互为同分异构体D.分子中所有C、N原子均处于同一平面
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用![]() 与
与![]() 反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得
反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得![]() ;③打开K,通入
;③打开K,通入![]() 直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出
直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出![]() ;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
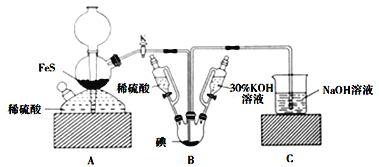
A.步骤②可观察到固体溶解,溶液由棕黄色变为无色
B.步骤③装置B中发生反应的离子方程式为![]()
C.步骤⑤中一系列操作为过滤,洗涤,合并滤液和洗液,蒸馏
D.装置C中氢氧化钠溶液的作用是吸收硫化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列是中学化学中熟悉的物质:
O2 金刚石 NaBr H2SO4 Na2CO3 Na2S NaHSO4
回答下列问题:
这些物质中,只含共价键的是________;只含离子键的是________;既含离子键又含共价键的是________。
(2)写出下列物质的电子式。
Na2O2:_________________;
NH4H:_______________________;
(3)写出下列物质的结构式。
CO2:____________________
H2O2:_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,反应的化学方程式为8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O。根据题意完成下列小题:
①在上述变化过程中,发生还原反应的过程是_____→____(填化学式)。
②该反应的氧化产物是________(填化学式)。
(2)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-。有关反应的离子方程式为_____。
(3)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
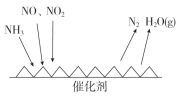
①由上图可知SCR技术中的氧化剂为_____________。
②用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1∶1时,写出该反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.3 mol·L-1硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图是已提供仪器,配制上述溶液均需用到的玻璃仪器是________(填选项)。
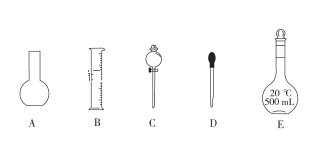
(2) 下列操作会使配制的NaOH溶液浓度偏低的是__________。
A 称量NaOH所用砝码生锈
B 选用的容量瓶内有少量蒸馏水
C 定容摇匀后,液面下降,又加水至刻度线
D 定容时俯视刻度线
(3)根据计算用托盘天平称取NaOH的质量为________g。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途。完成下列填空:
(1) 实验室配制氯化铝溶液时加入盐酸的目的是____________。
(2)往AlCl3溶液中加入过量下列溶液,最终得到无色澄清溶液的是______(填编号)。
a Na2CO3 b NaOH c NaAlO2 d H2SO4
取AlCl3溶液,用小火持续加热至水刚好蒸干,生成白色固体的组成可表示为:Al2(OH)nCl(6-n),为确定n的值,取3.490g白色固体,全部溶解在0.1120 mol的HNO3(足量)中,并加水稀释成100 mL,将溶液分成两等价,进行如下实验:
(3)一份与足量氨水充分反应后过滤、洗涤、灼烧,最后得Al2O3的质量为1.020g。判断加入氨水已足量的操作是________。过滤、洗涤后至少要灼烧_______次(填写数字);测定样品中铝元素含量时不选择测定干燥Al(OH)3的质量,而是测定A12O3的质量的原因可能是____(选填编号)。
a 干燥Al(OH)3固体时易失水 b Al2O3的质量比Al(OH)3大,误差小
c 沉淀Al(OH)3时不完全 d 灼烧氧化铝时不分解
(4)从另一份溶液中取出20.00 mL,用0.1290 mol/L的标准NaOH溶液滴定过量的硝酸,滴定前滴定管读数为0.00 mL,终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管)。则滴定管的读数__________mL,Al2(OH)nCl(6-n)中n的值为__________。
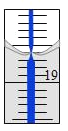
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W可用作高分子膨胀剂,一种合成路线如下:
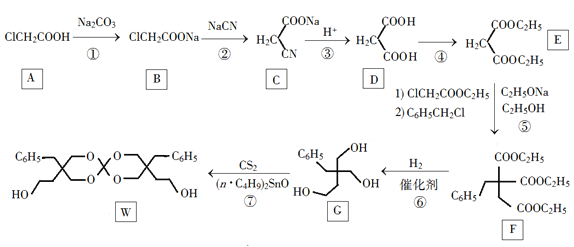
回答下列问题:
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)反应④所需试剂,条件分别为________。
(4)G的分子式为________。
(5)W中含氧官能团的名称是____________。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。
(7)苯乙酸苄酯(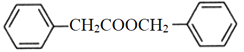 )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2的制取及其在污水处理方面的应用是当前科学研究的热点。
(1)“氧阴极还原法”制取H2O2的原理如题图所示:
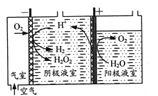
阴极表面发生的电极反应有:
Ⅰ.2H++O2+2e-=H2O2
Ⅱ. H2O2+2H++ 2e-=2H2O
Ⅲ. 2H+ +2e-=H2↑
①写出阳极表面的电极反应式:___。
②其他条件相同时,不同初始pH(均小于2)条件下,H2O2浓度随电解时间的变化如图所示,c(H+)过大或过小均不利于H2O2制取,原因是_______。
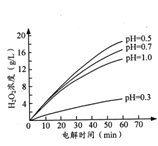
(2)存碱性条件下,H2O2的一种催化分解机理如下:
H2O2(aq)+Mn2+(aq)=·OH(aq)+Mn3+(aq)+OH-(aq) H=akJ/mol
H2O2(aq)+ Mn3+(aq) +2OH-(aq)= Mn2+(aq) +·O2-(aq) +2H2O(l) H=bkJ/mol
·OH(aq) +·O2-(aq)=O2(g) +OH-(aq) H=ckJ/mol
2H2O2(aq)= 2H2O(l)+O2(g) △H=_______ 。该反应的催化剂为 ____。
(3)H2O2、O3在水中可形成具有超强氧化能力的羟基自由基(·OH),可有效去除废水中的次磷酸根离子(H2PO2-)。
①弱碱性条件下·OH将H2PO2-氧化成PO43-,理论上l.7g·OH可处理含0.001mol/L H2PO2-的模拟废水的体积为______。
②为比较不同投料方式下含H2PO2-模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4。反应相同时间,实验结果如图所示:
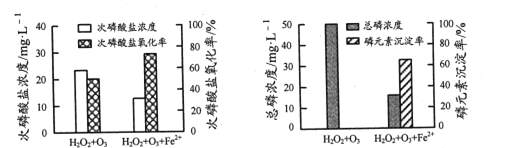
添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③6.4g CH4 ④0.5mol HCl ,下列关系正确的是( )
A.体积大小: ④>③>②>①B.原子数目: ③>①>④>②
C.密度大小: ④>②>③>①D.质量大小: ④>③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com