
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某工厂利用此矿石炼制精铜的工艺流程如图所示(已知:Cu2O+2H+===Cu+Cu2++H2O)。
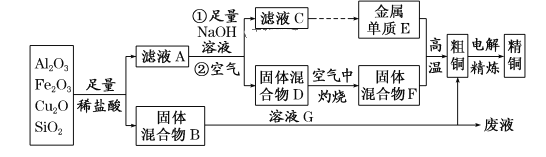
(1)滤液A中铁元素的存在形式为______________(填离子符号),生成该离子的离子方程式为_______________,检验滤液A中存在该离子的试剂为___________(填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_________________________,在实验室中完成此实验还需要的试剂是________。
a.KClO3 b.KCl c.Mg d.MnO2
(3)为使固体混合物D在空气中灼烧完全分解,应_____________,直至连续两次测定的实验结果相同(或质量相差小于0.1 g)时为止;灼烧时必须用到的实验仪器是__________。
(4)溶液G与固体混合物B反应的离子方程式为__________________________。
(5)将Na2CO3溶液滴入到一定量的CuCl2溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,则该盐的化学式是______。
【答案】Fe2+2Fe3++Cu===2Fe2++Cu2+铁氰化钾溶液(或氯水和KSCN溶液、双氧水和KSCN溶液等,合理即可)2Al+Fe2O3![]() Al2O3+2Feac灼烧,冷却至室温后称重,重复多次坩埚SiO2+2OH-===SiO32-+H2OCu2(OH)2CO3[或Cu(OH)2·CuCO3]
Al2O3+2Feac灼烧,冷却至室温后称重,重复多次坩埚SiO2+2OH-===SiO32-+H2OCu2(OH)2CO3[或Cu(OH)2·CuCO3]
【解析】
某铜矿石的成分中含有Cu2O,还含有少量的Al2O3、Fe2O3和SiO2,加入足量稀盐酸过滤,Cu2O溶于酸反应生成铜和铜盐,所以固体混合物B为Cu、SiO2,滤液A中为亚铁离子、铝离子和铜离子,加入足量氢氧化钠溶液过滤得到固体混合物D为氢氧化铜、氢氧化铁,滤液为C为AlO2-离子,通入二氧化碳生成氢氧化铝沉淀,氢氧化铝分解得到氧化铝,电解熔融氧化铝得到金属E为Al,固体混合物D空气中加热灼烧得到氧化铁和氧化铜,和铝发生铝热反应得到粗铜,含有铁杂质,粗铜精炼得到精铜;固体混合物B中加足量的NaOH溶液,过滤,滤渣为Cu,滤液为硅酸钠溶液,据此分析可得结论。
(1)Cu2O溶于酸反应生成铜和铜盐,铜和铁离子反应生成亚铁离子,所以滤液A中为亚铁离子,检验亚铁离子方法为:先加KSCN溶液,若不变色,再加氯水,变红色,说明含有亚铁离子,故答案为:Fe2+、2Fe3++Cu===2Fe2++Cu2+、铁氰化钾溶液(或氯水和KSCN溶液、双氧水和KSCN溶液等,合理即可);
(2)金属Al与氧化铁和氧化铜发生置换反应生成金属单质,该反应的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe,2Al+3CuO
Al2O3+2Fe,2Al+3CuO![]() Al2O3+3Cu,其中用于焊接钢轨为2Al+Fe2O3
Al2O3+3Cu,其中用于焊接钢轨为2Al+Fe2O3![]() Al2O3+2Fe,进行铝热反应还需要氯酸钾和镁条来引发该反应,故答案为:2Al+Fe2O3
Al2O3+2Fe,进行铝热反应还需要氯酸钾和镁条来引发该反应,故答案为:2Al+Fe2O3![]() Al2O3+2F、ac;
Al2O3+2F、ac;
(3)为使固体完全分解,应反复灼烧,多次称量,灼烧应在坩埚中进行,故答案为:灼烧,冷却至室温后称重,重复多次;坩埚;
(4)固体混合物B中加足量的NaOH溶液,二氧化硅与之反应生成硅酸钠和水,故答案为:SiO2+2OH-===SiO32-+H2O;
(5)生成的绿色的不溶于水的盐(不含结晶水)为铜绿,化学式为:Cu2(OH)2CO3,故答案为:Cu2(OH)2CO3[或Cu(OH)2·CuCO3]。


科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法不正确的是( )
A.元素周期表有7个横行,每一个横行是一周期
B.元素周期表有18个纵行,每一个纵行是一族
C.第ⅡA族元素全部是金属元素
D.第ⅦA族元素全部是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 乙醇能使酸性高锰酸钾溶液褪色,被氧化生成CO2和H2O
B. ![]() 和C4Hl0的二氯代物的数目不同(不含立体异构)
和C4Hl0的二氯代物的数目不同(不含立体异构)
C. 乙烯能使溴水褪色、能使酸性KMnO4溶液褪色,它们发生反应的类型不同
D. 植物油通过氢化可以变成脂肪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
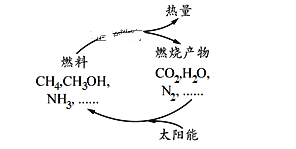
(1)在上图构想的物质和能量循环中太阳能最终转化为____________能。
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g)![]() 2CH3OH(g)+3O2(g)。
2CH3OH(g)+3O2(g)。
一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
①用CH3OH表示0~3 min内该反应的平均反应速率为______________________。
②能说明该反应已达到平衡状态的是_______________。
a.v正(H2O)=2v逆(CO2) b.n(CH3OH) :n(O2)=2 :3
c.容器内密度保持不变 d.容器内压强保持不变
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的____极(填“正”或“负”),通入氧气的一极的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分含Fe元素的徽粒在溶液中的物质的量分数与溶液pH的关系如图所示,下列说法正确的是

A. HFeO4-在水中的电离程度小于水解程度
B. B、C两点对应溶液中水的电离程度:B > C
C. B点溶液加适里水稀释,溶液中所有离子浓度均减小
D. 由A点数据可知,H2FeO4的第一步电离平衡常数Ka1=4.15×l0-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为易溶于水的化合物,其离子组成如下表。(各化合物中离子组成不重复)
阳离子 | Na+、Al3+、Ag+、Ba2+、Fe3+ |
阴离子 | Cl-、CO32-、SO42-、NO3-、OH- |
分别取溶液进行如下实验:
①用pH试纸分别测得B、C溶液均呈碱性,且0.1 molL B溶液pH>13;
②D溶液加入铜粉,溶液质量增加;
③在E溶液中逐滴滴入B至过量,先生成白色沉淀,后沉淀完全溶解;
④在A溶液中逐滴滴入氨水至过量,先生成白色沉淀,后沉淀完全溶解。
请回答下列问题:
(1)B的名称;_______________,E的名称;______________。
(2)C水溶液呈碱性原因:_____________(用离子方程式表示);0.1mol/L的C溶液中和0.1mol/L的NaHCO3溶液中,阴离子的总数:C溶液___________NaHCO3溶液。(填“>”或 “<”)
(3)D溶液呈________(填“酸性”“碱性”或“中性”)。若将D溶液加热蒸干得到固体应是__________(填化学式)。若将E溶液加热蒸干后再高温灼烧得到固体应是___________ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌-空气电池(原理如下图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时下列说法正确的是
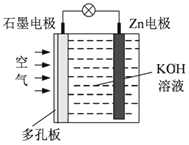
A. 氧气在石墨电极上发生氧化反应
B. 该电池的石墨电极是负极
C. 该电池放电时电子经氢氧化钾溶液向石墨电极移动
D. 该电池的负极反应为Zn-2e-+2OH-=ZnO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧铅蓄电池的回收利用是发展循环经济的必经之路。其阴、阳极填充物(铅膏,主要含PbO、PbO2 等)是废旧铅蓄电池的主要部分,回收时所得黄丹(PbO)可用于合成三盐基硫酸铅(组成可表示为3PbO·PbSO4·H2O),其工艺流程如下:
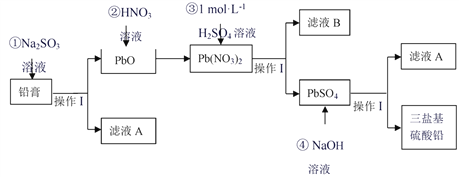
(1)铅膏中加入Na2SO3溶液所发生的离子方程式_____________。
(2)操作I的名称__________。用18.4 mol L-1H2SO4 配制100 mL1 mol L-1H2SO4溶液需要用到的仪器有量筒、烧杯、玻璃棒、胶头滴管、__________。
(3)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有蒸发浓缩、______、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是__________。
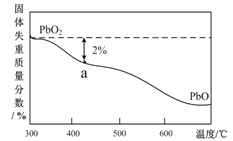
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重2.0% (![]() ×100%)的残留固体,若a点固体表示为PbOx或mPbO nPbO2,
×100%)的残留固体,若a点固体表示为PbOx或mPbO nPbO2,
列式计算x值_________和m:n值__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com