
据报道,N5是破坏力极强的炸药之一,18O2是比黄金还贵的物质。下列说法正确的是( )
A. N5和N2互为同位素  B. 2N5==5N2是化学变化
B. 2N5==5N2是化学变化
C. 原子半径:N<18O D. 18O2的摩尔质量为36
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:计算题
某研究性学习小组同学对由NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2 g | 15.7 g | 27.6 g |
V(CO2)(标况) | 2.24 L | 3.36 L | 3.36 L |
试计算:
(1)混合物与盐酸反应的的离子方程式 ;
(2)盐酸的物质的量浓度;
(3)混合物中两物质的物质的量之比。
查看答案和解析>>
科目:高中化学 来源:2017届江西省九江市十校高三第二次联考理科综合化学试卷(解析版) 题型:填空题
氮的化合物在生产生活中广泛存在。
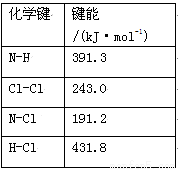
(1)①氯 胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)  N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况
N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况 如下表所示:
如下表所示:
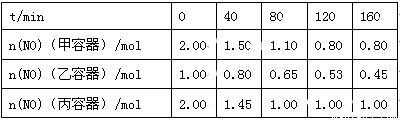
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
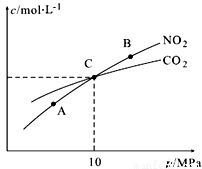
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三实验班第六次月考理综化学试卷(解析版) 题型:选择题
在一定温度下,容积固定的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)  2NO2(g),体系中各物质浓度随时间变化如图所示,则下列叙述错误的是
2NO2(g),体系中各物质浓度随时间变化如图所示,则下列叙述错误的是
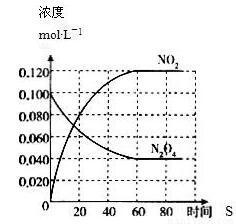
A. 若温度升高,混合气体的颜色变深
B. 在该温度下反应2NO2(g)  N2O4(g)的平衡常K为25/9
N2O4(g)的平衡常K为25/9
C. 反应达平衡后,将反应容器的容积减少一半,平衡向正反应方向移动
D. 反应达平衡后,向此容器中通入NO2气体,则c(NO2)增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一3月月考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
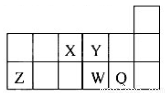
A. 离子Y2-和Z 3+的核外电子数和电子层数都不相同。
B. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ。
C. 元素X与元素Z的最高正化合价之和的数值等于8。
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高一3月月考化学试卷(解析版) 题型:选择题
有aXn-和bYm+两种简单离子,且X、Y均为短周期元素,已知Xn-比Ym+多2个电子层,下列关系和说法正确的是( )
A. Y可能是第二周期元素 B. a-b+n+m的和只可能等于10
C. b大于 5 D. X只能是第三周期元素
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高一3月月考化学试卷(解析版) 题型:选择题
下列说法中不正确的是( )
①质子数相同的粒子一定属于同种元素;
②同位素的性质几乎完全相同;
③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子;
④电子数相同的粒子不一定是同一种元素;
⑤一种元素只能有一种质量数;
⑥某种元素的相对原子质量取整数,就是其质量数
⑦元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑧核外电子排布相同的微粒化学性质不一定相同
⑨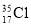 与
与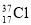 得电子能力相同
得电子能力相同
A. ①②④⑤ B. ③④⑤⑥ C. ②③⑤⑥ D. ①②⑤⑥
查看答案和解析>>
科目:高中化学 来源:河北省2017届高三下学期三调考试理科综合化学试卷 题型:填空题
烯烃在化工生产过程中有重要意义。下面是以烯烃A为原料合成粘合剂M的路线图。

回答下列问题:
(1)下列关于路线图中的有机物或转化关系的说法正确的是_______(填字母)。
A. A能发生加成、氧化、缩聚等反应
B.B的结构简式为CH2ClCHClCH3
C. C的分子式为C4H5O3
D. M的单体是CH2=CHCOOCH3和CH2=CHCONH2
(2)A中所含官能团的名称是_______,反应①的反应类型为_________。
(3)设计步骤③⑤的目的是_________, C的名称为________。
(4)C和D生成粘合剂M的化学方程式为____________。
(5)满足下列条件的C的同分异构体共有__种(不含立体异构),写出其中核磁共振氢谱有3组峰的同分异构体的结构简式:_____________。
①能发生银镜反应 ② 酸、碱性条件下都能水解 ③ 不含环状结构
(6)结合信息,以CH3CH=CHCH2OH为原料(无机试剂任选),设计制备CH3CH=CHCOOH的合成路线。合成路线流程图示例如下:_____________
查看答案和解析>>
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:简答题
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的热点。
(1) NaBH4是一神重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为_________,反应消耗1molNaBH4时转移的电子数目为___________。
(2) H2S热分解可制氢气。反应方程式:2H2S(g)=2H2(g)+S2(g) △H;在恒容密闭容器中,测得H2S分解的转化率(H2S起始浓度均为c mol/L)如图1所示。图l中曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。
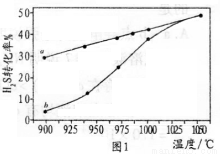
①△H ______0(填“>”“<”或“=”);
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则t min内反应速率v(H2)=_____(用含c、t的代数式表示);
③请说明随温度升高,曲线b向曲线a接近的原因____________。
(3) 使用石油裂解的副产物CH4可制取H2,某温度下,向体积为2L的密闭容器中充入0.40mol CH4(g)和0.60molH2O(g)的浓度随时间的变化如下表所示:

①写出此反应的化学方程式_________,此温度下该反应的平衡常数是_________。
②3 min时改变的反应条件是_________(只填一种条件的改变)。
③一定条件下CH4的平衡转化率与温度、压强的关系如图2所示。则P1_________P2填“>”、“<”或“=“)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com