
 铁(26Fe)是地球上分布最广的金属之一,约占地壳质量的5.1%,居元素分布序列中的第四位,仅次于O、Si和Al.请结合所学知识回答下列问题:
铁(26Fe)是地球上分布最广的金属之一,约占地壳质量的5.1%,居元素分布序列中的第四位,仅次于O、Si和Al.请结合所学知识回答下列问题:
分析 (1)Fe的原子序数为26,原子结构示意图为 ,以此可确定在周期表中的位置;
,以此可确定在周期表中的位置;
(2)Fe(OH)2不稳定,易被氧化生成Fe(OH)3;
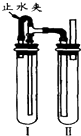
(3)在装置I中加入Fe和稀硫酸制备FeSO4,然后利用气体压强将I中FeSO4挤入装置II中发生复分解反应制取Fe(OH)2,所以装置II中加入的试剂是NaOH溶液,据此分析解答.
解答 解:(1)Fe的原子序数为26,原子核外有4个电子层,最外层电子数为2,原子结构示意图为 ,位于周期表第四周期第Ⅷ族,
,位于周期表第四周期第Ⅷ族,
故答案为:四;Ⅷ; ;
;
(2)氢氧化亚铁不稳定,在空气中容易被氧化成氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,现象是白色沉淀变为灰绿色,最后变为红褐色,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)用NaOH溶液、铁屑、稀H2SO4等制备Fe(OH)2时应该防止Fe(OH)2被氧化,在装置I中加入Fe和稀硫酸制备FeSO4,然后利用气体压强将I中FeSO4挤入装置II中发生复分解反应制取Fe(OH)2,所以装置II中加入的试剂是NaOH溶液,
①通过以上分析知,试管I中加入的试剂是稀硫酸和铁屑,故答案为:稀硫酸和铁屑;
②II中试剂是NaOH溶液,故答案为:NaOH溶液;
③为了制得白色Fe(OH)2沉淀,在试管I和Ⅱ中加入试剂,打开止水夹,塞紧塞子后先检验试管II中排除氢气纯度,当氢气纯净时,关闭止水夹,铁和稀硫酸反应生成的氢气使I中压强增大,导致I中硫酸亚铁溶液通过导管进入II,从而发生复分解反应生成氢氧化亚铁白色沉淀,所以塞紧塞子后的操作步骤是:检验试管Ⅱ出口处排出的氢气的纯度.当排出的H2纯净时,再夹紧止水夹,
故答案为:检验试管Ⅱ出口处排出的氢气的纯度.当排出的H2纯净时,再夹紧止水夹.
点评 本题考查铁及其化合物的性质以及氢氧化亚铁的制备,侧重考查基本原理,明确物质性质是解本题关键,注意制取氢氧化亚铁时要防止氢氧化亚铁被氧化,本题还考查学生基本实验操作、思维的缜密性等,题目设计很好.


科目:高中化学 来源: 题型:多选题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.075 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R,金属性L>Q | |
| B. | M与T形成的化合物具有两性 | |
| C. | L2+与R2-的核外电子数相等 | |
| D. | L的原子半径最大,电负性最小,T的原子半径最小,电负性最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间 | |
| C. | Na和H2O的反应不是离子反应,因为反应中没有离子参加 | |
| D. | Na在Cl2中燃烧不是氧化还原反应,因为没有得氧或失氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
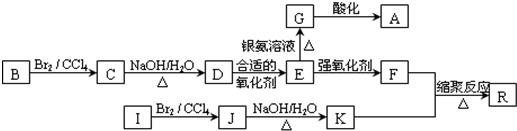

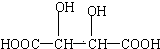 ;
;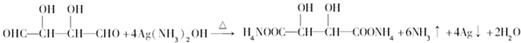 ;
;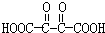 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$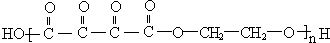 +(2n-1)H2O;
+(2n-1)H2O;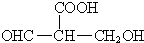 或
或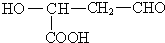 或
或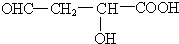 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入金属钠 | B. | 利用质谱法 | ||
| C. | 利用红外光谱 | D. | 利用核磁共振氢谱仪 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 蛋白质水解的最终产物是多肽 | |
| C. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| D. | 石油裂解和油脂皂化都是由高分子生成小分子的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,沸点196.5℃.请回答下列问题:
,沸点196.5℃.请回答下列问题: 的沸点>196.5℃.(填“>”、“<”或“=”)原因是
的沸点>196.5℃.(填“>”、“<”或“=”)原因是 能形成分子间氢键,
能形成分子间氢键, 能形成分子内氢键,分子间氢键能提高物质的沸点
能形成分子内氢键,分子间氢键能提高物质的沸点查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com