
合成氨的温度和压强通常控制在约500℃以及20 MPa~50 MPa的范围,当进入合成塔的N2和H2的体积比为1∶3时,经科学实验测定,在相应条件下N2和H2反应所得氨的平衡浓度(体积分数)如下表所示:

而实际上从合成塔出来的混合气体中含有氨约为15%。
请回答下列问题:
(1)298 K下合成氨时,每生成1 mol 氨气,同时放出46.2 kJ的热量,则该反应的热化学方程式为_________________________________________________。
氨气,同时放出46.2 kJ的热量,则该反应的热化学方程式为_________________________________________________。
在该温度下,取1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在的条件下进行反应,测得反应放出的热量总小于92.4 kJ,其原因是______________。
(2)实际上从合成塔出来的混合气体中氨的体积分数小于理论值的根本原因是_______________。
A.表中所测数据有明显误差
B.生产条件控制不当
C.氨的分解速率大于预测值
D.合成塔中的反应未达到平衡状态
(3)若工业生产中N2和H2按投料比1∶2.8的比例进入合成塔,那么转化率较大的应该是_________,采用此投料比的原因是______________,
若从合成塔出来的混合气体中氨的体积分数仍为15%,则N2和H2的转化率之比是__________。
(1)根据题意,生成2 mol NH3所放出的热量为46.2 kJ×2=92.4 kJ,该反应的热化学方程式为N2(g)+3H2(g)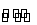 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
由于合成氨的反应是一个可逆反应,1 mol N2和3 mol H2反应不可能完全转化为NH3,所以放出的热量总小于92.4 kJ。
(2)从合成塔出来的混合气体中氨的体积分数小于理论值,其根本原因是反应没有达到平衡状态。
(3)若投料比为1∶2.8,相当于增加了N2的用量,可以提高H2的转化率。
N2(g) + 3H2(g) 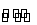 2NH3(g)
2NH3(g)
起始量 1 2.8 0
变化量 x 3x 2x
平衡量 1-x 2.8-3x 2x
根据题意: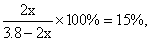 解得x≈0.248。
解得x≈0.248。
N2、H2的转化率之比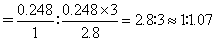
答案:(1)N2(g)+3H2(g)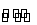 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
合成氨的反应是一个可逆反应,1 mol N2和3 mol H2反应不可能完全转化为NH3
(2)D (3)H2 增加相对廉价原料N2的用量,提高相对贵重原料H2的转化率,降低生产成本 1∶1.07


科目:高中化学 来源: 题型:
已知: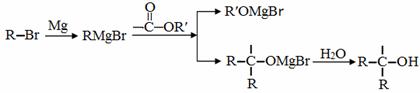
A是一种重要的化工原料,能使溴水反应褪色,且分子内所有的原子都在一条直线上,在不同的条件下,A可以转化为烃B和烃C,B和C的核磁共振氢谱中都只有一个吸收峰,B能使溴水反应褪色而C不能使溴水反应褪色。A~J分别代表一种有机物,并有如下的转化关系:
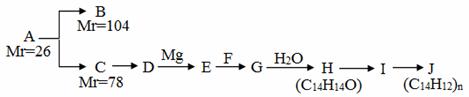
回答下列问题:
(1)A的结构简式为________________;
(2)B的结构简式为_________________;
(3)反应C→D所需要的试剂是_________________________;
(4)H不能发生催化氧化,H的结构简式是____________________________________;
(5) I中的官能团名称是___________________;
(6) I中可能含有的杂质是_____________________(写结构简式);
(7)写出I→J的反应方程式________________________________________________;
(8)H有多种同分异构体,符合下列条件的同分异构体有________种。
①能与FeCl3溶液显紫色;②有二联苯结构;③二联苯上有两个侧链。
其中核磁共振氢谱中吸收峰最少的结构简式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对σ键的认识不正确的是( )
A.σ键不属于共价键,是另一种化学键
B.S-Sσ键与S-Pσ键的对称性相同
C.分子中含有共价键,则至少含有一个σ键
D.含有π键的化合物与只含σ键的化合物的化学性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
448 mL某气体在标准状况下的质量为0.64 g,该气体的摩尔质量约为( )
A.64 g B.64 C.64 g·mol-1 D.32 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,向一个2 L的真空密闭容器中事先装入催化剂,通入1 mol N2和3 mol H2,经过一段时间后,测得容器内压强为反应起始的0.9倍,在此时间内以H2表示的平均速率为0.1 mol·L-1·min-1,则所经过的时间是( )
A.5 min B.4 min C.3 min D.2 min
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,1 mol/L的NH4Cl、CH3COONH4、NH4HSO4三种溶液中,测得c(NH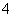 )分别为a、b、c(单位为mol/L),下列判断正确的是 ( )
)分别为a、b、c(单位为mol/L),下列判断正确的是 ( )
A.a=b=c B.a>b>c C.a>c>b D.c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2。
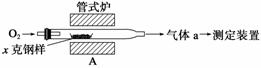
①气体a的成分是________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2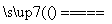 1________+3________。
1________+3________。
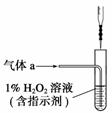
(2)将气体a通入测硫装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式
________________________________________________________________________
________________________________________________________________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液,若消耗1 mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:________。
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
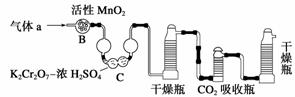
①气体a通过B和C的目的是_______________________________________________。
②计算钢样中碳的质量分数,应测量的数据是___________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示。

(1)X的单质与A反应的化学方程式是 。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是 。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是 。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示) 。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com