
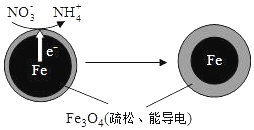
 ���������Fe��ȥ��ˮ���е������Σ�NO3- ���ѳ�Ϊ�������о����ȵ�֮һ��
���������Fe��ȥ��ˮ���е������Σ�NO3- ���ѳ�Ϊ�������о����ȵ�֮һ��| ��ʼpH | pH=2.5 | pH=4.5 |
| NO3-��ȥ���� | �ӽ�100% | ��50% |
| 24СʱpH | �ӽ����� | �ӽ����� |
| ��������������̬ | 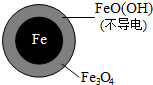 |  |
���� ��1����Fe��ԭˮ����NO3-����������Fe3O4Ϊ����ʣ���Fe����ԭ����ʧȥ���ӣ���������
��NO3-�������õ��ӷ�����ԭ��Ӧ����NH4+������ͼ2��Ϣ��֪Ϊ���Ի�����
��2��pHԽ�ߣ�Fe3+Խ��ˮ������FeO��OH����
��3��Fe2+����FeO��OH����Ӧ����Fe3O4�������ӣ�
��� �⣺��1����Fe��ԭˮ����NO3-����Fe����ԭ����ʧȥ���ӣ���������
�ʴ�Ϊ������
��NO3-�������õ��ӷ�����ԭ��Ӧ����NH4+������ͼ2��Ϣ��֪Ϊ���Ի������������ĵ缫��ӦʽΪ��NO3-+8e-+10H+=NH4++3H2O��
�ʴ�Ϊ��NO3-+8e-+10H+=NH4++3H2O��
��2��pHԽ�ߣ�Fe3+Խ��ˮ������FeO��OH������FeO��OH�������磬�谭����ת�ƣ�����NO3-��ȥ���ʵͣ��������ӷ���ʽΪ��Fe3++2H2O?FeO��OH��+3H+���ʴ�Ϊ��Fe3++2H2O?FeO��OH��+3H+��
��3��Fe2+����FeO��OH����Ӧ����Fe3O4�������ӣ����ӷ���ʽΪ��Fe2++2FeO��OH��=Fe3O4+2H+��Fe2+���������FeO��OH��ת��Ϊ�ɵ����Fe3O4�����ڵ���ת�ƣ�
�ʴ�Ϊ��Fe2++2FeO��OH��=Fe3O4+2H+��
���� ������Ҫ���黯ѧ��Ӧԭ�����漰�绯ѧ��������ԭ��Ӧ�����֪ʶ�����е�Fe��NO3-�ķ�Ӧ����Һ������йأ�ץס��һ���ǽ���Ĺؼ����ѶȲ���


 ��ѧ����ϵ�д�
��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
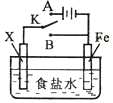
| A�� | ��XΪп��������K����A�����ɼ������ĸ�ʴ�����ַ�����Ϊ�������������������� | |
| B�� | ��XΪͭ��������K����A����װ���з������ܷ�ӦΪ��2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$2NaOH+Cl2��+H2�� | |
| C�� | ��XΪ̼��������K����B������ʳ��ˮ�е����̪��Һ�ɿ���̼�������ȱ�� | |
| D�� | ��XΪ̼��������K����B���������������������軯����Һ�ɿ�����Һ��Ѫ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | p���ף���p���ң���p������ | B�� | p���ף���p���ң���p������ | C�� | p���ף���p��������p���ң� | D�� | p���ң���p���ף���p������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ٻ�� | B�� | �ڻ�� | C�� | �ٻ�� | D�� | �ۻ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������������������ֱ���ȫȼ�գ����߷ų��������� | |
| B�� | ��C�����ʯ����C��ʯī����H=-1.9KJ/mol ��֪�����ʯ��ʯī�ȶ� | |
| C�� | ��101Kpaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8KJ����������ȼ�յ��Ȼ�ѧ����ʽΪ��2H2��g��+O2��g��=2H2O��l����H=+285.8KJ/mol | |
| D�� | ϡ��Һ�У�H+��aq��+OH-��aq��=H2O��l����H=-53.7KJ/mol��������1 mol CH3COOH�뺬1 mol NaOH����Һ��ϣ��ų�������С��53.7KJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�Ӱ뾶�Ĵ�С˳��r��Y����r��Z����r��W�� | |
| B�� | Ԫ��Z��W�ļ����ӵĵ��Ӳ�ṹ��ͬ | |
| C�� | Ԫ��Y �ļ���̬�⻯������ȶ��Ա�Z ��ǿ | |
| D�� | ֻ��X��Y��Z����Ԫ�صĻ����һ���ǹ��ۻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ¬ɪ�� | C�� | ������ | D�� | ��ķ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C6H12O6 | B�� | C2H5OH | C�� | HCHO | D�� | CH3COOH |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com