
化学知识在生产和生活中有着重要的应用,下列说法中不正确的是
A.明矾常做净水剂
B.与铜质水龙头连接处的钢质水管易发生腐蚀
C.大量燃烧化石燃料是造成雾霾天气的一种重要因素
D.金属钠着火时,可以使用泡沫灭火器来灭火
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为_________,B为________,C为__________。(6分)
(2)E的电子式为_____________。(2分)
(3)写出D的最高价氧化物的水化物和A单质反应的化学方程式:
_______________________________________________________。(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A(C8H8O3)为无色液体,难溶于水,有特殊香味,从A出发,可发生图示的一系列反应,图中的化合物A苯环上取代时可生成两种一取代物,化合物D能使FeCl3溶液显紫色,G能进行银镜反应。E和H常温下为气体。试回答:
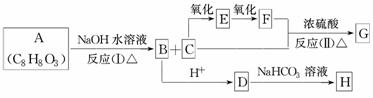
(1)写出下列化合物的结构简式:
A:________;B:________;G:________。
(2)C中的官能团名称为________。
(3)反应类型:(Ⅰ)________;(Ⅱ)________。
(4)写出D→H的化学方程式:____________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
)Heck反应是合成C—C键的有效方法之一,如反应①:
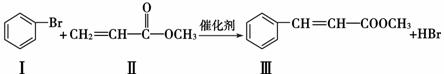
化合物Ⅱ可由以下合成路线获得:
Ⅳ(分子式C3H6O3)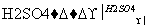 Ⅴ
Ⅴ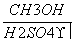 Ⅱ
Ⅱ
(1) 化合物Ⅲ的分子式为__________,1 mol化合物Ⅲ最多可与__________mol H2发生加成反应。
(2)化合物Ⅳ分子结构中有甲基,写出由化合物Ⅳ反应生成化合物Ⅴ的化学方程式
________________________________________________________________________
________________ ________________________________________________________。
________________________________________________________。
(3)有关化合物Ⅱ说法正确的 是( )
是( )
A.1 mol 化合物Ⅱ完全燃烧消耗5 mol O2
B.化合物Ⅱ能使酸性高锰酸钾溶液褪色
C.化合物Ⅱ难溶于水
D.化合物Ⅱ分子间聚合,反应生成的高聚物结构为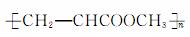
(4)化合物Ⅲ的一种同分异构体Ⅵ,苯环上的一氯取代物有两种,Ⅵ能与NaHCO3溶液反应生成无色气体,除苯环上的氢外核磁共振氢谱还有四组峰,峰面积之比为1∶1∶1∶3,Ⅵ的结构简式为________________________________________________________________________。
(5)CH3Ⅰ和O也可以发生类似反应①的反应,有机产物的结构简式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列浓度关系正确的是( )
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B. 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO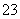 )>c(OH-)>c(HCO
)>c(OH-)>c(HCO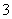 )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: CH4(g) + H2O(g) = CO(g) + 3H2(g) △H= +206kJ/mol
CO(g) + H2O(g) = CO2(g) + H2(g) △H= -41 kJ/mol
C—H、H—O、H—H的键能分别为413 kJ/mol、463kJ/mol、436 kJ/mol,
则CO2中C=O的键能为
A.797.5 kJ/mol B. 682 kJ/mol C.572 kJ/mol D.483 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )
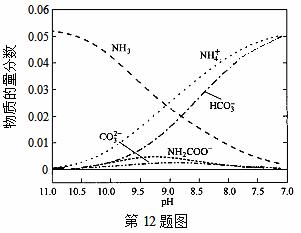
A.在pH=9.0时,c(NH4+)>c(HCO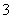 )>c(NH2COOˉ)>c(CO32-)
)>c(NH2COOˉ)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ)
C.随着CO2的通入,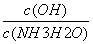 不断增大
不断增大
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
|
化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
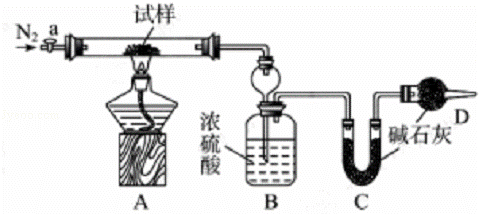
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.
实验过程:
Ⅰ.按图组装仪器,检查装置的气密性;
Ⅱ.将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3g;
Ⅲ.关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g.
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为,.
(2)装置B的作用为.装置C的作用为.
(3)实验过程中通入N2的目的 为.
为.
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是bce(填选项字母)
| 序号 | a | b | c | d | e |
| 数据 | m1,m2,m3 | m2,m3,m4,m5 | m1,m2,m4 | m1,m4,m5 | m1,m3,m5 |
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3),若能,则w(NaHCO3)的计算式为:×100%(若不能,此问不作答.)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com