
| A. | 当V(CO2)≤0.56L时,发生的离子反应式为CO2+Ba2++2OH-═BaCO3↓+H2O | |
| B. | 当V(CO2)>1.68L时,发生的离子反应式为BaCO3+H2O+CO2═Ba2++HCO3- | |
| C. | NaOH的物质的量浓度为0.05mol•L-1 | |
| D. | 当V(CO2)=1.96L时,BaCO3与Ba(HCO3)2的物质的量之比为2:1 |
分析 常温下pH=13的溶液中氢氧根离子浓度为0.1mol/L,1L该溶液中含有氢氧根离子的物质的量为0.1mol;持续通入CO2气体产生沉淀的质量最大为4.925g,说明生成碳酸钡的最大物质的量为$\frac{4.925g}{197g/mol}$=0.025mol,根据质量守恒定律可知原溶液中含有氢氧化钡的物质的量为0.025mol,根据氢氧根离子的总物质的量可知NaOH的物质的量为:0.1mol-0.025mol×2=0.05mol,即原溶液中含有0.025mol氢氧化钡、0.05molNaOH,据此进行解答.
解答 解:常温下pH=13的溶液中c(OH-)=0.1mol/L,1L该溶液中n(OH-)=0.1mol;持续通入CO2气体产生沉淀的质量最大为4.925g,该沉淀为碳酸钡,n(BaCO3)=$\frac{4.925g}{197g/mol}$=0.025mol,根据质量守恒可知原溶液中n(Ba(OH)2)=0.025mol,根据氢氧根离子的总物质的量可知n(NaOH)=0.1mol-0.025mol×2=0.05mol,
A.标况下0.56L二氧化碳的物质的量为:$\frac{0.56L}{22.4L/mol}$=0.025mol,当V(CO2)≤0.025mol时,只有氢氧化钡反应,反应的离子方程式为:CO2+Ba2++2OH-═BaCO3↓+H2O,故A正确;
B.当Ba(OH)2和NaOH恰好反应生成碳酸钡、碳酸钠时,n(CO2)=$\frac{1}{2}$n(OH-)=0.05mol,然后再通入二氧化碳时,碳酸钠开始反应,0.025mol碳酸钠转化成碳酸氢钠消耗0.025mol二氧化碳,所以碳酸钡开始溶解前消耗二氧化碳的总物质的量为:0.075mol,标况下0.075mol二氧化碳的体积为:22.4L/mol×0.075mol=1.68L,所以当当V(CO2)>1.68L时,碳酸钡开始溶解,反应的离子方程式为:BaCO3+H2O+CO2═Ba2++HCO3-,故B正确;
C.NaOH的物质的量浓度为:c(NaOH)=$\frac{0.05mol}{1L}$=0.05mol/L,故C正确;
D.当V(CO2)=1.96L时,二氧化碳的物质的量为:$\frac{1.96L}{22.4L/mol}$=0.0875mol,氢氧化钡、氢氧化钠与二氧化碳反应生成碳酸钡、碳酸氢钠消耗二氧化碳的物质的量为0.075mol,则溶解碳酸钡消耗二氧化碳的物质的量为:0.0875mol-0.075mol=0.0125mol,同时生成0.0125mol碳酸氢钡,反应后剩余0.0125mol碳酸钡,此时BaCO3与Ba(HCO3)2的物质的量之比为1:1,故D错误;
故选D.
点评 本题考查了离子方程式计算与书写,题目难度中等,正确判断混合物组成为解答关键,注意明确发生反应实质,试题培养了学生的分析能力及化学计算能力.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
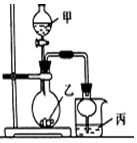 利用图所示装置进行下列实验,其中丙中实验现象描述正确的是( )
利用图所示装置进行下列实验,其中丙中实验现象描述正确的是( )| 实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
| A | 70%硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
| B | 浓盐酸 | KMnO4 | 含酚酞的NaOH溶液 | 溶液褪色 |
| C | 稀盐酸 | CaCO3 | BaCl2溶液 | 有白色沉淀生成 |
| D | 浓氨水 | CaO | AlCl3溶液 | 先生成白色沉淀然后沉淀溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
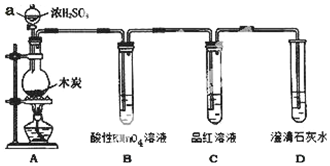 为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验:
为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaH2的电子式为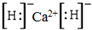 | |
| B. | Cl-的结构示意图: | |
| C. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| D. | 2,4,6-三硝基苯甲酸结构简式: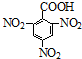 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的还原性很强,只能以化合态存在于自然界 | |
| B. | 钠质地柔软,可用小刀切割,保存在煤油中 | |
| C. | 钠失火后可用大量水或泡沫灭火器扑灭 | |
| D. | 钠的焰色反应为黄色,可用在雾天做指示灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式:CH2-CH2-CH2 | B. | 丙烷分子的比例模型: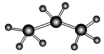 | ||
| C. | 四氯化碳分子的电子式: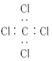 | D. | 1丁烯分子的键线式: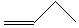 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com