
| A. | ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含共价键的离子化合物 | |
| B. | 在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键 | |
| C. | HI的相对分子质量比HF大,所以HI的沸点比HF高 | |
| D. | H与D、16O与18O互为同位素;H216O、D216O、H218O、D216O互为同素异形体 |
分析 A.ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,该化合物为Na2O2;
B.二氧化硅是原子晶体,每个Si原子和四个O原子形成共价键;
C.氢化物的熔沸点与相对分子质量成正比,但含有氢键的氢化物熔沸点较高;
D.质子数相同、中子数不同的同一元素不同原子互称同位素,同一元素的不同单质互称同素异形体.
解答 解:A.ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,该化合物为Na2O2,过氧化钠中含有离子键和共价键,为离子化合物,故A正确;
B.二氧化硅是原子晶体,每个Si原子和四个O原子形成共价键,每个O原子连接2个Si原子,故B错误;
C.氢化物的熔沸点与相对分子质量成正比,但含有氢键的氢化物熔沸点较高,HF中含有氢键但HI不含氢键,所以HF的熔沸点高于HI,故C错误;
D.质子数相同、中子数不同的同一元素不同原子互称同位素,同一元素的不同单质互称同素异形体,则H216O、D216O、H218O、D216O是化合物不是单质,所以不互称同素异形体,故D错误;
故选A.
点评 本题考查基本概念、氢键、化合物类型、化学键等知识点,明确物质构成微粒是解本题关键,侧重考查学生分析判断能力,注意二氧化硅中Si、O原子之间存在的化学键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在空气中燃烧都能生成过氧化物 | |
| B. | 与盐酸溶液反应时都能生成碱和氢气 | |
| C. | 熔沸点随原子序数增加而升高 | |
| D. | 还原性随原子电子层数的增加而增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
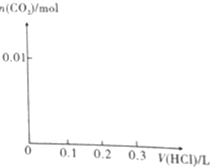 (1)将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.在如图所示坐标系中画出能正确表示加入盐酸的体积和生成CO2的物质的量的关系图象.
(1)将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.在如图所示坐标系中画出能正确表示加入盐酸的体积和生成CO2的物质的量的关系图象.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据系统命名法,CH3-CH=CH-CHO的名称是:丁烯醛 | |
| B. | 1 mol HCHO发生银镜反应最多生成2 mol Ag | |
| C. | 对甲基苯甲醛( )使酸性高锰酸钾溶液褪色,说明它含有醛基 )使酸性高锰酸钾溶液褪色,说明它含有醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性 | B. | 脱水性 | C. | 酸性 | D. | 吸水性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com