
分析 (1)明矾中含有铝离子,易水解生成氢氧化铝胶体,胶体吸附水中的悬浮物而净水;
(2)室温下取0.2mol•L-1HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,说明得到的盐是强酸弱碱盐;
(3)NaHA溶液中,HA-离子既电离也水解,测得溶液显碱性,说明其电离程度小于水解程度;
(4)①酸性条件下,Cr2O72-具有强氧化性,亚铁离子具有还原性,二者发生氧化还原反应生成铬离子和铁离子;
②根据氢氧化铁、氢氧化铬的溶度积进行计算.
解答 解:(1)明矾溶于水电离出铝离子,铝离子易水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中的悬浮物而净水,所以明矾能净水,离子方程式为Al3++3H2O?Al(OH)3+3H+,
故答案为:Al3++3H2O?Al(OH)3+3H+;
(2)等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐溶液呈酸性,说明该盐是强酸弱碱盐,弱碱电离可逆,其电离方程式为:MOH?M++OH-,
故答案为:MOH?M++OH-;
(3)①NaHA溶液中,HA-离子既电离也水解,电离产生A2-,水解生成H2A,由于c(H2A)>c(A2-),说明其电离程度小于水解程度,溶液呈碱性,
故答案为:碱性;
②NaHA溶液中,HA-离子既电离也水解,电离产生A2-,水解生成H2A,溶液显碱性,说明其电离程度小于水解程度,
故答案为:NaHA溶液显碱性,说明其电离程度小于水解程度;
(4)①酸性条件下,Cr2O72-具有强氧化性,亚铁离子具有还原性,二者发生氧化还原反应生成铬离子和铁离子,离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②若处理后的废水中残留的c(Cr3+)=3.0×10-6 mol•L-1,Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=6.0×10-31,则c3(OH-)=2×10-25mol/L,则残留的Fe3+的浓度为Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=4.0×10-38 ,带入解得c(Cr3+)=2×10-13mol•L-1,
故答案为:2×10-13.
点评 本题考查较综合,涉及难溶物的溶解平衡、离子浓度大小比较等知识点,题目难度较大,根据温度、电解质溶液对难溶物性质的影响和电荷守恒、物料守恒来分析解答即可,试题培养了学生的分析能力及灵活应用能力.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 与12C60化学性质相同 | B. | 与12C60互为同素异形体 | ||
| C. | 属于原子晶体 | D. | 与12C60互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇使酸性KMnO4溶液褪色,是因为发生了氧化反应 | |
| B. | 将苯加入溴水中,振荡后水层接近无色,是因为发生了取代反应 | |
| C. | 乙烯使溴的四氯化碳溶液褪色,是因为发生了加成反应 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色消失,是因为发生了取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

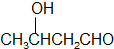 $→_{②}^{△}$CH3CH=CHCHO
$→_{②}^{△}$CH3CH=CHCHO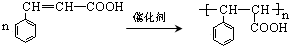 .
.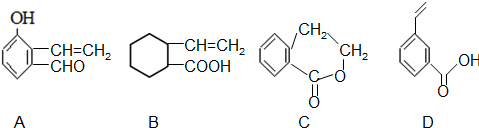
 →E 的合成路线(试剂及溶剂任选:合成路线参照“已知①”中书写形式)
→E 的合成路线(试剂及溶剂任选:合成路线参照“已知①”中书写形式) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
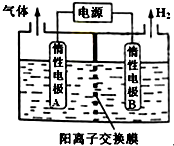 利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )
利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )| A. | B极区电解质溶液为LiOH溶液 | |
| B. | 阳极电极反应式为2Cl--2e-═Cl2↑ | |
| C. | 电解过程中主要是H+通过阳离子交换膜向B电极迁移 | |
| D. | 电极A连接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
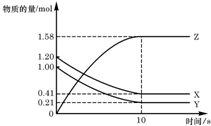 一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到 10s,用 Z 表示的反应速率为 0.158mol/(L•s) | |
| B. | 反应开始到 10s,X 的物质的量浓度减少了 0.79mol/L | |
| C. | 反应开始到 10s,Y 的转化率为 79.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com