
|
将等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为V,A,V,B,V,C已知VB==2VC且VA==VB+VC则在C的生成物中,该金属元素的化合价为 | |
| [ ] | |
A. |
+1 |
B. |
+2 |
C. |
+3 |
D. |
+4 |
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
(13 分)
(1)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。
① 图一是根据反应Zn + CuSO4 = Cu + ZnSO4设计成的锌铜原电池。电解质甲溶液是 (填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是 。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 。
(2)将蓝矾(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其 有效成分为难溶的碱式硫酸铜[xCuSO4·yCu(OH)2]。为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体。所得数据显示n(HCl)︰n(CuO)=3︰2,则该碱式硫酸铜的化学式中x︰y= 。
(3)E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:
xM(g)![]() Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
A.该反应的化学方程式是2HF![]() (HF)2
(HF)2
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时, 将增大
将增大
D.M的沸点比同主族下一周期元素的气态氢化物沸点低
查看答案和解析>>
科目:高中化学 来源:2011届辽宁省铁岭中学高三第四次模拟考试(理综)化学部分 题型:填空题
(13 分)
(1)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。
① 图一是根据反应Zn + CuSO4 =" Cu" + ZnSO4设计成的锌铜原电池。电解质甲溶液是 (填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是 。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 。
(2)将蓝矾(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其有效成分为难溶的碱式硫酸铜[xCuSO4 ·yCu(OH)2]。为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体。所得数据显示n(HCl)︰n(CuO)=3︰2,则该碱式硫酸铜的化学式中x︰y= 。
(3)E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:
xM(g) Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是 
A.该反应的化学方程式是2HF (HF)2 (HF)2 |
| B.平衡时混合气体的平均摩尔质量是33.3 |
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时, 将增大 将增大 |
| D.M的沸点比同主族下一周期元素的气态氢化物沸点低 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年辽宁省高三第四次模拟考试(理综)化学部分 题型:填空题
(13 分)
(1)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。
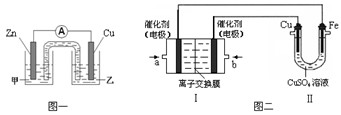
① 图一是根据反应Zn + CuSO4 = Cu + ZnSO4 设计成的锌铜原电池。电解质甲溶液是 (填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是 。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 。
(2)将蓝矾(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其 有效成分为难溶的碱式硫酸铜[xCuSO4 ·yCu(OH)2]。为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体。所得数据显示n(HCl)︰n(CuO)=3︰2,则该碱式硫酸铜的化学式中x︰y= 。
(3)E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:
xM(g) Mx
(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
Mx
(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
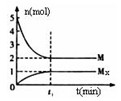
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时, 将增大
将增大
D.M的沸点比同主族下一周期元素的气态氢化物沸点低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com