
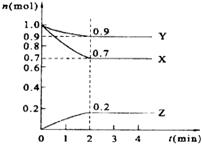
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 分析 由图象可知,反应达到2min时达到平衡状态,各物质的物质的量不变,根据图知,该反应中参加反应的△n(X)=(1.0-0.7)mol=0.3mol、△n(Y)=(1.0-0.9)mol=0.1mol、△n(Z)=(0.2-0)mol=0.2mol,则X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,以此可确定反应的化学方程式,并以此计算转化率、反应速率以及体积分数,以此解答该题.
解答 解:(1)2min时C的物质的量由1mol变化为0.7mol,则转化率为$\frac{1.0mol-0.7mol}{1.0mol}×100%$=30%,故答案为:30%;
(2)同一可逆反应同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,根据图知,该反应中参加反应的△n(X)=(1.0-0.7)mol=0.3mol、△n(Y)=(1.0-0.9)mol=0.1mol、△n(Z)=(0.2-0)mol=0.2mol,则X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,则该反应方程式为3X+Y?2Z,
故答案为:3X+Y?2Z;
(3)反应从开始至2min末,v(Z)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),v(X)=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075mol/(L•min),故答案为:0.05mol/(L•min);0.075mol/(L•min);
(4)由图象可知反应达到2min时达到平衡状态,X所占的体积分数为$\frac{0.7}{0.9+0.7+0.2}×100%$=38.9%,故答案为:2;38.9%.
点评 本题考查化学平衡有关计算,为高频考点,侧重考查学生分析计算能力,明确平衡状态图象特点、各个物理量之间的关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 质量 | B. | 原子数 | C. | 质子数 | D. | 密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
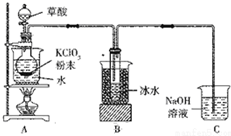 二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如图所示:
二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
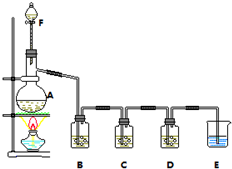 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 被测样品中含有加热不挥发的杂质 | B. | 被测样品中含有加热易挥发的杂质 | ||
| C. | 实验前被测样品已有部分失水 | D. | 加热前所用的坩埚未完全干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
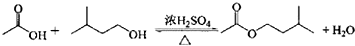
| 相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.813 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |
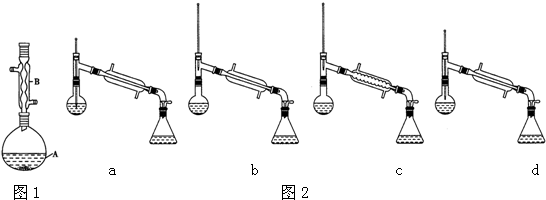
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
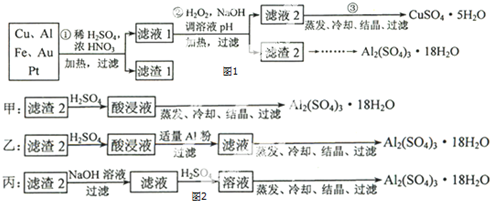
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com