
| A. | 增大H2的浓度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | N2与H2能100%转化为NH3 | D. | 升高温度能加快反应速率 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物的化学式为:C29H44O | |
| B. | 牛式二烯炔醇能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol牛式二烯炔醇最多可与6molBr2发生加成反应 | |
| D. | 牛式二烯炔醇分子内能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
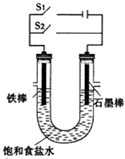 依据电化学反应原理,设计如图所示实验装置.请根据要求回答下列问题.
依据电化学反应原理,设计如图所示实验装置.请根据要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的酸性逐渐增强 | B. | 铜片逐渐溶解 | ||
| C. | 溶液中H+向锌片作定向移动 | D. | 锌片是负极并被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com