
| A. | 与足量酸反应:离子方程式相同 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 常温下在水中的溶解度:Na2CO3>NaHCO3 | |
| D. | 等物质的量与足量酸反应产生CO2的质量:Na2CO3<NaHCO3 |
分析 A.Na2CO3与足量酸反应为碳酸根与氢离子反应生成二氧化碳和水,而NaHCO3与足量酸反应为碳酸氢根与氢离子反应生成二氧化碳和水;
B.碳酸氢钠受热易分解,而碳酸钠较稳定;
C.相同条件下,碳酸氢钠的溶解度小;
D.利用关系式Na2CO3~CO2,NaHCO3~CO2来分析生成二氧化碳的质量大小.
解答 解:A.Na2CO3与足量酸反应为碳酸根与氢离子反应生成二氧化碳和水,反应的离子方程式为:CO32-+2H+=H2O+CO2↑,而NaHCO3与足量酸反应为碳酸氢根与氢离子反应生成二氧化碳和水,反应的离子方程式为:HCO3-+H+=+H2O+CO2↑,两个反应的离子方程式不同,故A错误;
B.碳酸氢钠受热易分解,不稳定,则热稳定性为:Na2CO3>NaHCO3,故B错误;
C.Na2CO3和NaHCO3在相同条件下,碳酸氢钠的溶解度小,则在水中的溶解度大小为:Na2CO3>NaHCO3,故C正确;
D.Na2CO3和NaHCO3的物质的量相等,根据关系式Na2CO3~CO2、NaHCO3~CO2可知,产生的CO2的物质的量相等,则产生CO2的质量:Na2CO3=NaHCO3,故D错误;
故选C.
点评 本题考查碳酸钠和碳酸氢钠的性质,题目难度不大,涉及溶解度、稳定性、与酸的反应等知识,明确碳酸钠、碳酸氢钠的性质为解答关键,试题有利于提高学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
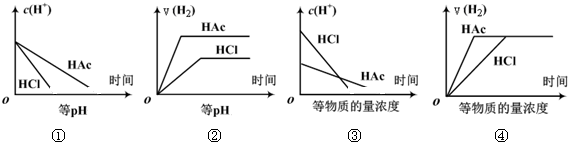
| A. | ①③ | B. | ②④ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A. | 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) | |
| C. | 点c所示溶液中:c(SO42-)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 点d所示溶液中:c(SO42-)>c(NH3•H2O)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X溶液 | 固体Y |  |
| A | 浓硫酸 | 铜粉 | |
| B | 浓氨水 | CaO | |
| C | 稀盐酸 | 石灰石 | |
| D | 浓盐酸 | 高锰酸钾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
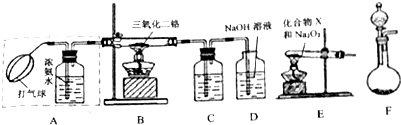
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
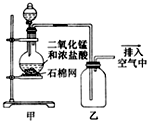
| A. | 该装置图中至少存在两处明显错误 | |
| B. | 烧瓶中的MnO2可换成KMnO4 | |
| C. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 | |
| D. | 在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com