
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25 ℃)。
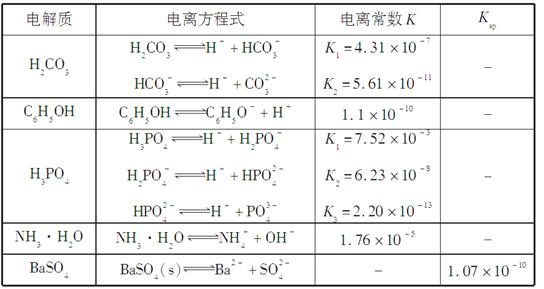
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式______________。
(2)25 ℃时,向10 mL 0.01 mol·L-1 C6H5OH溶液中滴加V mL 0.01 mol·L-1氨水,混合溶液中粒子浓度关系正确的是________(填选项字母)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH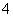 )=c(C6H5O-)+c(C6H5OH)
)=c(C6H5O-)+c(C6H5OH)
c.V=10时,混合液中水的电离程度小于0.01 mol·L-1 C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH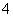 )>c(C6H5O-)>c(H+)>c(OH-)
)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义。25℃时,Na2CO3第一步水解反应的水解常数Kh=________
mol·L-1。
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
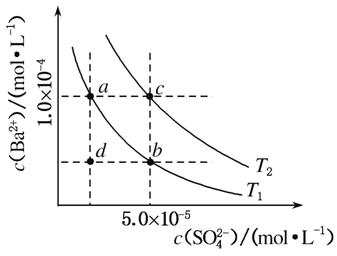
①T2________25 ℃(填“>”“<”或“=”)。
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是________(填选项字母)。
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
解析 (1)根据表中电离常数可知C6H5OH的酸性比HPO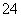 的酸性强,但比H2PO
的酸性强,但比H2PO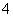 的酸性弱,故C6H5OH与Na3PO4反应生成Na2HPO4。(2)由表中数据可知,NH3·H2O的电离常数大于C6H5OH的电离常数,故V<10时,混合液也可能呈碱性,a项错误;当V=5时,由物料守恒可知2[c(NH3·H2O)+c(NH
的酸性弱,故C6H5OH与Na3PO4反应生成Na2HPO4。(2)由表中数据可知,NH3·H2O的电离常数大于C6H5OH的电离常数,故V<10时,混合液也可能呈碱性,a项错误;当V=5时,由物料守恒可知2[c(NH3·H2O)+c(NH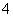 )]=c(C6H5OH)+c(C6H5O-),b项正确;当V=10时,相当于生成了C6H5ONH4,该物质水解,促进水的电离,而C6H5OH电离出H+,抑制水的电离,故V=10时,混合液中水的电离程度大于0.01 mol·L-1 C6H5OH溶液中水的电离程度,c项错误;由溶液中的电荷守恒可知c(NH
)]=c(C6H5OH)+c(C6H5O-),b项正确;当V=10时,相当于生成了C6H5ONH4,该物质水解,促进水的电离,而C6H5OH电离出H+,抑制水的电离,故V=10时,混合液中水的电离程度大于0.01 mol·L-1 C6H5OH溶液中水的电离程度,c项错误;由溶液中的电荷守恒可知c(NH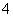 )+c(H+)=c(OH-)+c(C6H5O-),因混合液pH<7,c(H+)>c(OH-),故c(NH
)+c(H+)=c(OH-)+c(C6H5O-),因混合液pH<7,c(H+)>c(OH-),故c(NH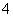 )<c(C6H5O-),d项错误。(3)Kh=
)<c(C6H5O-),d项错误。(3)Kh=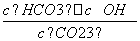 =
=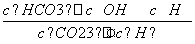 =
=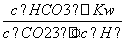 =
= =
=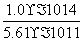 =1.78×10-4(mol·L-1)。(4)①由图象中的c点可知,T2时,c(Ba2+)·c(SO
=1.78×10-4(mol·L-1)。(4)①由图象中的c点可知,T2时,c(Ba2+)·c(SO )=1.0×10-4×5.0×10-5=5.0×10-9>Ksp,故T2>25 ℃。②加入硫酸钠,溶液中的c(SO
)=1.0×10-4×5.0×10-5=5.0×10-9>Ksp,故T2>25 ℃。②加入硫酸钠,溶液中的c(SO )增大,而Ksp不变
)增大,而Ksp不变 ,c(Ba2+)必然减小,由图象可知,加入硫酸钠,可以由a点变为b点,a项错误;在T1曲线上方区域(不含曲线),有c(Ba2+)·c(SO
,c(Ba2+)必然减小,由图象可知,加入硫酸钠,可以由a点变为b点,a项错误;在T1曲线上方区域(不含曲线),有c(Ba2+)·c(SO )>Ksp,因此均有硫酸钡沉淀生成,b项正确;蒸发溶剂,溶液中c(Ba2+)和c(SO
)>Ksp,因此均有硫酸钡沉淀生成,b项正确;蒸发溶剂,溶液中c(Ba2+)和c(SO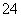 )均增大,可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),c项正确;升高温度,Ksp增大,但硫酸钡溶液中c(Ba2+)和c(SO
)均增大,可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),c项正确;升高温度,Ksp增大,但硫酸钡溶液中c(Ba2+)和c(SO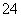 )始终相等,d项错误。
)始终相等,d项错误。
答案 (1 )C6H5OH+PO
)C6H5OH+PO ===C6H5O-+HPO
===C6H5O-+HPO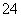 (2)b
(2)b


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
工业上制备BaCl2的工艺流程图如下:
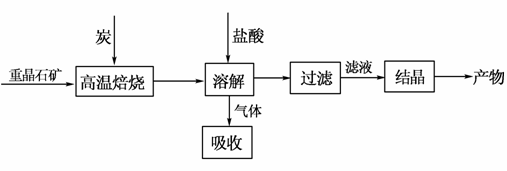
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C(s)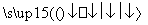 4CO(g)+BaS(s)
4CO(g)+BaS(s)
ΔH1=+571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)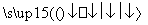 2CO2(g)+BaS(s)
2CO2(g)+BaS(s)
ΔH2=+226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为________________________________________________。
(2)反应C(s)+CO2(g)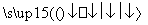 2CO(g)的ΔH=________kJ·mol-1。
2CO(g)的ΔH=________kJ·mol-1。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将A2和B2气体通入1 L密闭容器中,反应按下式进行:mA2+nB22C,2 s内反应速率如下:v(A2)=0.5 mol·L-1·s-1,v(B2)=1.5 mol·L-1·s-1,v(C)=1 mol·L-1·s-1,则m和n的值分别为( )
A.2、3 B.3、2
C.3、1 D.1、3
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)2NH3(g)
ΔH=-92.4 kJ·mol-1
一种工业合成氨的简易流程图如下:
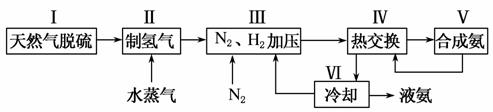
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式_____________________________________________________ _____________________________________________________________________________________。
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________(填选项字母)。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为______________________ __________________________________________________。
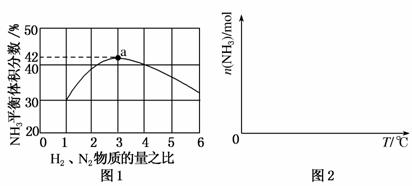
(3)图1表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数为________。
(4)依据温度对合成氨反应的影响,在图2坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,将a mol/L的氨水与b mol/L盐酸等体积混合,下列有关推论不正确的是( )
A.若混合后溶液pH=7,则c(NH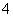 )=c(Cl-)
)=c(Cl-)
B.若b=2a,则c(Cl-)>c(NH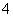 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.若a=2b,则c(NH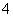 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
D.若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的描述和该性质的应用均正确的是( )
A.FeCl3具有氧化性,用FeCl3溶液刻蚀印刷电路板
B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃
C.过氧化钠只有 氧化性,用过氧化钠为潜水艇舱提供氧气
氧化性,用过氧化钠为潜水艇舱提供氧气
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸铝镁
[ MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和____________。
(2)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为________。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率( ×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
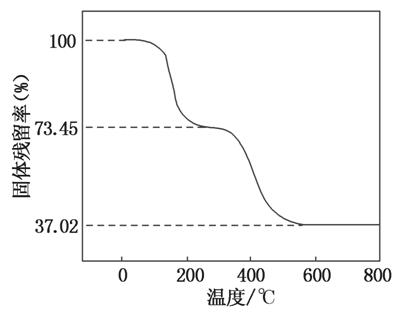
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)n(CO )(写出计算过程)。
)(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+F2(g) === 2HF(g) △H=-270kJ/mol,下列说法正确的是( )
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
利用“化学计量在实验中的应用”的相关知识进行填空
(1)在标准状况下,0.5mol任何气体的体积都约为 L。
(2)1.5mol H2SO4的质量是 ,所含分子数目为 。
(3)配制500mL 1mol/L HNO3溶液,需16mol/L HNO3溶液的体积为 mL.
(4)在9.5g某二价金属的氯化物中含0.2mol Cl—,此氯化物的摩尔质量为 ;
该金属元素的相对原子质量为 。
(5)在一定的温度和压强下,1体积X2 (g)跟3体积Y2 (g)化合生成2体积化合物,则该化合物的化学式是___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com