
| ||
| A、CH4是还原剂,CO2是氧化剂 |
| B、1mol CO2完全反应需转移2mol电子 |
| C、CO既是氧化产物又是还原产物 |
| D、氧化产物和还原产物的物质的量之比为1:1 |
| ||


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小苏打溶液中加入过量的烧碱溶液:HCO3-+OH-═CO32-+H2O |
| B、澄清石灰水中通入过量的CO2:CO2+OH-═HCO3- |
| C、Cl2与水反应生成盐酸和次氯酸Cl2+H2O═H++Cl-+HClO |
| D、向氯化铝溶液中加入足量氨水:Al3++4NH3?H2O═AlO2-+2H2O+4NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第二周期第IA族 |
| B、第二周期第IIA族 |
| C、第三周期第IA族 |
| D、第三周期第IIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐类的水解实质上是破坏了水的电离平衡,促进了水的电离 |
| B、沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
| C、原电池的正极一定是化学性质较不活泼的金属 |
| D、在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )| A、原子半径:Z>Y>X |
| B、氢化物稳定性:X<Y |
| C、氢化物沸点:Z>Y |
| D、最高价氧化物对应的水化物酸性:W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
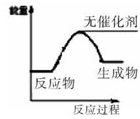 联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP 二氧化碳排放比2005年下降40%-45%.
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP 二氧化碳排放比2005年下降40%-45%.
| ||
| ||
| ||
| 太阳光 |
| 高温 |
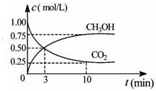
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com