
| 序号 | ① | ② | ③ | ④ |
| 科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立 近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为 各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
 ,写出Z元素气态氢化物的电子式:
,写出Z元素气态氢化物的电子式: .
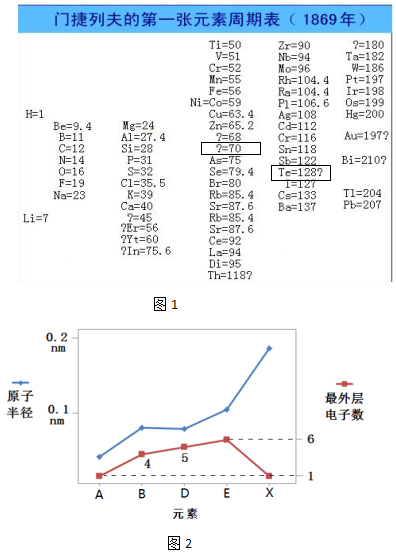
.分析 (1)1865年,纽兰兹发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复,1803年,道尔顿创立 近代原子论,率先开始相对原子质量的测定工作,1829年,德贝莱纳发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值,1862年,尚古尔多认为 各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联;
(2)①结合表中给出的是相对原子质量分析;相对原子质量为70的元素信息分析;结合表中信息;表中提供的数据都是元素的相对原子质量,据此进行分析;“Te=128?”怀疑Te的相对原子质量不是128;
②科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化.其本质原因是随着核电荷数递增,原子核外电子排布呈现周期性变化;
(3)Y的最高价氧化物的水化物与强酸、强碱均能反应,故Y是两性元素且是短周期元素,故Y为Al,X与Y处于同一周期,故X为第三周期元素,且X最外层1个电子,故X为Na,Z的单质常温下为气态,同条件下相对于氢气的密度比为35.5.故Z为Cl,同一周期从左到右,半径依次减小,故B和D为第二周期元素,E为第三周期元素,B最外层4个电子,故B为C,D最外层5个电子,故D为N,E最外层6个电子,故E为S,据此进行分析,
①上述七种元素中,处于第二周期的有C、N;X为Na,在周期表中的位置是第三周期,第ⅠA族;
②E为S,其原子结构示意图为 ;Z为Cl,其气态氢化物为HCl,氢原子最外层1个电子,氯原子最外层7个电子,HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物;
;Z为Cl,其气态氢化物为HCl,氢原子最外层1个电子,氯原子最外层7个电子,HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物;
③B为C与E的最高价氧化物的水化物为H2SO4,反应生成二氧化碳,二氧化硫和水;Y为Al与X的最高价氧化物的水化物为NaOH,反应生成偏铝酸钠和水;
④B和D的最高价氧化物的水化物的化学式分别为H2CO3、HNO3;C原子和N原子具有相同电子层,N原子的核电荷数多于C,N原子半径小于C,N原子核对最外层电子的吸引作用大于C;故N非金属性强于C.
解答 解:(1)1865年,纽兰兹发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复,1803年,道尔顿创立 近代原子论,率先开始相对原子质量的测定工作,1829年,德贝莱纳发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值,1862年,尚古尔多认为 各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联,故上述科学家的研究按照时间先后排序合理的是②③④①,
故答案为:②③④①;
(2)①结合表中信息得,给出的是元素的相对原子质量,故同一横行元素性质相似;结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是相对原子质量为70的元素;“Te=128?”怀疑Te的相对原子质量不是128,故第5列方框中“Te=128?”的问号表达的含义是怀疑Te的相对原子质量不是128;
故答案为:横行;相对原子质量为70的元素;怀疑Te的相对原子质量不是128;
②科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化.其本质原因是随着核电荷数递增,原子核外电子排布呈现周期性变化,
故答案为:A;
(3)Y的最高价氧化物的水化物与强酸、强碱均能反应,故Y是两性元素且是短周期元素,故Y为Al,X与Y处于同一周期,故X为第三周期元素,且X最外层1个电子,故X为Na,Z的单质常温下为气态,同条件下相对于氢气的密度比为35.5.故Z为Cl,同一周期从左到右,半径依次减小,故B和D为第二周期元素,E为第三周期元素,B最外层4个电子,故B为C,D最外层5个电子,故D为N,E最外层6个电子,故E为S,据此进行分析,
①上述七种元素中,处于第二周期的有C、N;X为Na,在周期表中的位置是第三周期,第ⅠA族;
故答案为:C、N;第三周期,第ⅠA族;
②E为S,其原子结构示意图为 ;Z为Cl,其气态氢化物为HCl,HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物其电子式为
;Z为Cl,其气态氢化物为HCl,HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物其电子式为 ,
,
故答案为: ;
; ;
;
③B为C与E的最高价氧化物的水化物为H2SO4,反应生成二氧化碳,二氧化硫和水,故化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O; Y为Al与X的最高价氧化物的水化物为NaOH,反应生成偏铝酸钠和水,故化学方程式为2Al+2H2O+2NaOH═2NaAlO2+3H2↑,据强酸,强碱,大多数盐拆,故离子方程式为2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;2Al+2H2O+2OH-═2AlO2-+3H2↑;
④B和D的最高价氧化物的水化物的化学式分别为H2CO3、HNO3;碳酸酸性比硝酸弱;B和D的非金属性有差异,原因是C原子和N原子具有相同电子层,N原子的核电荷数多于C,N原子半径小于C,N原子核对最外层电子的吸引作用大于C,故N非金属性强于C,
故答案为:H2CO3;HNO3;弱于;C原子和N原子具有相同电子层,N原子的核电荷数多于C,N原子半径小于C,N原子核对最外层电子的吸引作用大于C,故N非金属性强于C.
点评 本题考查了位置、结构与性质的关系,题目难度较大,正确推断各元素名称为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | c(K+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+) | |
| B. | c(K+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol•L-1 | |
| D. | c(OH-)═c(H+)+2c(H2CO3)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子式为C6H6 | B. | 属于不饱和烃 | C. | 能在空气中燃烧 | D. | 无色无毒的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
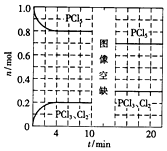 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:| A. | 0~4min的平均速率v(Cl2)=0.05mol/(L•min ) | |
| B. | 10min时改变的条件是分离出一定量的PCl5 | |
| C. | 起始时向该容器中充入2.0mol PCl3和2.0molCl2,保持温度为T,反应达平衡时放出的热量大于1.6akJ | |
| D. | 温度为T,起始时向该容器中充入1.0mol PCl5、0.10mol PCl3和0.10molCl2,反应达到平衡前,v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
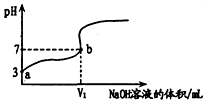 常温下,用0.1000mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程溶液pH随NaOH溶液的体积的变化曲线如图所示(忽略中和热效应).下列说法不正确的是( )
常温下,用0.1000mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程溶液pH随NaOH溶液的体积的变化曲线如图所示(忽略中和热效应).下列说法不正确的是( )| A. | 常温下,HA的电离常数K(HA)约为10-5 | |
| B. | v1<20 | |
| C. | 溶液中水的电离程度:a点>b点 | |
| D. | 滴定过程为了确定滴定终点,最合适的指示剂是酚酞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
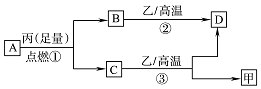 已知X、Y、Z是三种原子序数依次增大的短周期元素.甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10个电子.它们之间转化关系如图所示.下列说法正确的是( )
已知X、Y、Z是三种原子序数依次增大的短周期元素.甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10个电子.它们之间转化关系如图所示.下列说法正确的是( )| A. | 原子半径:Z>Y>X | B. | 稳定性:A>C | ||
| C. | 反应②和③均为吸热反应 | D. | X、Y、Z可以形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 证明还原性:I->Fe2+ | 向FeI2和KSCN混合溶液中滴入少量氯水,再加入CCl4,振荡 |
| B | 制备Fe(OH)3胶体 | 向饱和FeCl3溶液中滴加氨水并不断搅拌 |
| C | 分离苯和四氯化碳 | 用分液漏斗进行分液 |
| D | 制取NH3 | 直接加热NH4Cl固体,用向下排空气法收集气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与浓H2SO4共热170℃ | B. | 乙烯使溴水褪色 | ||
| C. | 甲苯与浓硫酸、浓硝酸混合 | D. | 苯与Cl2一定条件生成六氯环己烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com