
| A. | 铍原子失电子的能力比钙弱 | B. | 砹的氢化物不如碘化氢稳定 | ||
| C. | 硒酸的酸性比硫酸强 | D. | 氢氧化锶的碱性比氢氧化钙强 |
分析 A、同主族元素,从上到下失电子能力逐渐增强;
B、同主族元素,从上到下氢化物的稳定性逐渐减弱;
C、同主族元素,从上到下最高价氧化物的水化物的酸性逐渐减弱;
D、同主族元素,从上到下其最高价氧化物对应水化物的碱性逐渐增强.
解答 解:A、同主族元素的原子,从上到下失电子能力逐渐增强,所以铍(Be)的原子失电子能力比钙弱,故A正确;
B、同主族元素的原子,从上到下氢化物的稳定性逐渐减弱,碘的氢化物不稳定,所以砹(At)的氢化物不稳定,故B正确;
C、同主族元素,从上到下最高价氧化物的水化物的酸性逐渐减弱,所以硒酸的酸性比硫酸弱,故C错误;
D、同主族元素的原子,从上到下其最高价氧化物对应水化物的碱性逐渐增强,所以氢氧化锶[(Sr(OH)2]比氢氧化钙的碱性强,故D正确.
故选C.
点评 本题考查了元素周期表和元素周期律的应用,根据元素金属性强弱与其最高价氧化物的水化物碱性强弱、元素非金属性强弱与其最高价氧化物的水化物酸性强弱及其氢化物的稳定性之间的关系分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2的电子式为 Na${\;}_{•}^{•}$$\stackrel{••}{O}$${\;}_{•}^{•}$${\;}_{•}^{•}$$\stackrel{••}{O}$${\;}_{•}^{•}$Na | |
| B. | NH4Br的电子式: +Br- +Br- | |
| C. | 氢氧根离子的电子式:[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | |
| D. | HClO的电子式:H${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1352 | B. | 1456 | C. | 496 | D. | 360 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 5 | C. | 6 | D. | 10000 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CBr2F2 | B. | CH3CH2OH | C. | CH3CH2CH3 | D. | CH3CH(OH)COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验示意图 | 实验现象 | 解释 |
甲: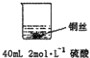 | 无明显现象 | 稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,不能将氢置换出来. |
乙: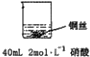 | 铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝 | 稀硝酸是氧化性的酸,能与铜发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com