
| A�� | pH��2.33 | B�� | pH��3.53 | C�� | pH��3.53 | D�� | pH��2.33 |
���� FeS��K${\;}_{sp}^{��}$=c��Fe2+��•c��S2-��=6.3��10-18��H2S��${K}_{{a}_{1}}^{��}•{K}_{{a}_{2}}^{��}$=$\frac{{c}^{2}��{H}^{+}��•c��{S}^{2-}��}{c��{H}_{2}S��}$=1.4��10-20����ӦFeS+H2S?FeS+2H+��K=$\frac{{c}^{2}��{H}^{+}��}{c��F{e}^{2+}��•c��{H}_{2}S��}$��������������֮��Ĺ�ϵʽ���м��㣮
��� �⣺FeS��K${\;}_{sp}^{��}$=c��Fe2+��•c��S2-��=6.3��10-18��H2S��${K}_{{a}_{1}}^{��}•{K}_{{a}_{2}}^{��}$=$\frac{{c}^{2}��{H}^{+}��•c��{S}^{2-}��}{c��{H}_{2}S��}$=1.4��10-20����ӦFeS+H2S?FeS+2H+��K=$\frac{{c}^{2}��{H}^{+}��}{c��F{e}^{2+}��•c��{H}_{2}S��}$���õ�K=$\frac{K{a}_{1}•K{a}_{2}}{Ksp}$��c2��H+��=$\frac{1.4��1{0}^{-20}}{6.3��1{0}^{-18}}$��0.1��0.1�����c��H+��=$\frac{\sqrt{2}}{3}��1{0}^{-2}$mol/L��pH=2.33����ʹFe2+������FeS��������Һ��pH��2.33��
��ѡD��
���� ���⿼��ѧ����ѧƽ�ⳣ�����йؼ���֪ʶ��ע��֪ʶ��Ǩ��Ӧ���ǹؼ����Ѷ��еȣ�


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 +
+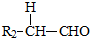 $��_{��}^{ϡNaOH}$
$��_{��}^{ϡNaOH}$ ��R��R��Ϊ�������⣩
��R��R��Ϊ�������⣩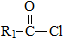 +R2OH$\stackrel{һ������}{��}$
+R2OH$\stackrel{һ������}{��}$ +HCl ��R��R��Ϊ������
+HCl ��R��R�������� ��
��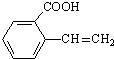 ��
�� ��
�� ��
�� ������֮һ����
������֮һ���� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ҵ���Ʊ�H2��һ����Ҫ�����ǣ�CO��g��+H2O��g��?CO2 ��g��+H2��g����H=Q kJ/mol����֪�÷�Ӧ��ƽ�ⳣ��K���¶�T�Ĺ�ϵ��ͼ��ʾ������һ�̶����ܱ������У�850��ʱ����������Ӧ����������ڸ����ʵ�Ũ�� ��mol/L����ʱ��ı仯��ϵ���±���
��ҵ���Ʊ�H2��һ����Ҫ�����ǣ�CO��g��+H2O��g��?CO2 ��g��+H2��g����H=Q kJ/mol����֪�÷�Ӧ��ƽ�ⳣ��K���¶�T�Ĺ�ϵ��ͼ��ʾ������һ�̶����ܱ������У�850��ʱ����������Ӧ����������ڸ����ʵ�Ũ�� ��mol/L����ʱ��ı仯��ϵ���±���| ʱ��/min | CO��g�� | H2O��g�� | CO2��g�� | H2��g�� |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2O4�������ӻ����� | B�� | X�����ӷ���ΪN2O+ | ||
| C�� | Y�����ӷ���ΪNO2- | D�� | ͭ��Һ��N2O4��Ӧ������NO���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��������Ϊ2-��-1-��ϩ��
��������Ϊ2-��-1-��ϩ�� +
+ $��_{��}^{Ũ����}$
$��_{��}^{Ũ����}$ +H2O��
+H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com