
| A. | 将a molL-1 HCN溶液与a molL-1 NaOH溶液等体积混合,混合液中:c(OH-)>c(H+),c(Na+)>c(CN-) | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| D. | NaHCO3和Na2CO3混合液中,一定有c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
分析 A.amol•L-1HCN溶液与amol•L-1NaOH溶液等体积混合,则生成的是NaCN溶液,是强碱弱酸盐;
B.电离常数越大,酸性越强,盐的水解规律:越弱越水解,所以水解能力:碳酸钠>氰化钠>醋酸钠;
C.溶液的导电性和离子浓度大小有关,电离度和溶液的浓度有关,pH大小值取决于溶液的氢离子浓度大小;
D、根据溶液中的电荷守恒来分析,溶液中存在c(Na+)、c(H+),阴离子c(OH-)、c(HCO3-)、c(CO32-),阴阳离子所带电荷总数相同.
解答 解:A.amol•L-1HCN溶液与amol•L-1NaOH溶液等体积混合,则生成的是NaCN溶液,是强碱弱酸盐,溶液显碱性,c(OH-)>c(H+),c(Na+)>c(CN-)成立,故A正确;
B.根据表中酸的电离平衡常数,可以知道酸性顺序是:醋酸>氢氰酸>碳酸氢根,盐的水解规律:越弱越水解,所以水解能力:碳酸钠>氰化钠>醋酸钠,即pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故B错误;
C.冰醋酸原来没有水,然后加水溶于水电离,到达冰醋酸全部电离后,导电性最大,PH最小,继续加水,虽然总的电离的分子多了,但是氢离子和醋酸根离子浓度下降很快,导电性下降,PH增加,趋向7,无限稀释后,导电性极弱,PH≈7,所以冰醋酸中逐滴加水,溶液导电性先增强后减弱,根据越稀越电离的规律,则电离度逐渐增大,开始阶段是电离阶段,氢离子浓度逐渐增大,pH减小,达到电离平衡以后,再稀释,氢离子浓度减小,pH增大,即pH均先减小后增大,故C错误;
D.NaHCO3和Na2CO3混合溶液中,溶液存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D错误;
故选A.
点评 本题考查盐类水解、弱电解质的电离及溶液中离子浓度的关系,题目难度中等,明确溶液中的溶质及酸性强弱的比较、电荷守恒是解答本题的关键,侧重于考查学生的分析能力和对基础知识的应用能力.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
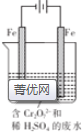 铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀.已知铬在自然界最重要的矿物是铬铁矿[Fe(CrO2)2或FeO.Cr2O3],工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程.
铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀.已知铬在自然界最重要的矿物是铬铁矿[Fe(CrO2)2或FeO.Cr2O3],工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程.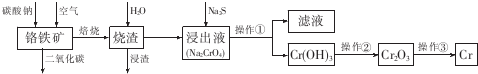
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
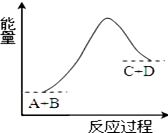
| A. | 该反应只有在加热条件下才能进行 | |
| B. | 该反应中D的能量可能大于反应物A和B的能量之和 | |
| C. | 该反应为放热反应 | |
| D. | 反应物的总能量高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:r(Na+)>r(Mg2+)>r(Al3+) | B. | 酸性强弱:HClO>H2SO3>H3PO4 | ||
| C. | 稳定性:HF>H2O>H2S | D. | 碱性强弱:Pb(OH)4>Sn(OH)4>Ge(OH)4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
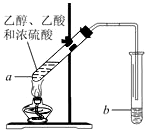 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热.
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、NO3-、Na+、Cl- | B. | K+、HCO3-、Cl-、Al3+ | ||
| C. | NO3-、Fe2+、H+、Br- | D. | K+、Cl-、SO42-、NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com