
【题目】下列关于原电池的叙述中正确的是( )
A.原电池是将化学能直接转变为电能的装置
B.原电池负极发生的电极反应是还原反应
C.原电池在工作时其正极不断产生电子并经外电路流向负极
D.原电池的电极只能由两种不同的金属构成
科目:高中化学 来源: 题型:
【题目】用大理石粉末与3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )
A. 加入水 B. 改用1mol/L盐酸 C. 改用块状大理石 D. 适当升高温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学欲研究SO2的相关性质。
(1)比较下表中的两组物质关系,第2组中物质X的化学式是 。
第1组 | 第2组 |
C、CO、CO2、H2CO3、Na2CO3、、NaHCO3、 | S 、SO2、SO3、X、Na2SO4、NaHSO4 |
(2)利用下图装置来检验SO2的性质
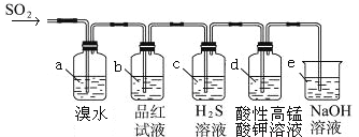
①装置a中的现象是: ; (填“能”或“不能”)说明 SO2 有漂白性
②若装置e中有40 mL 2.5 molL-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生反应的总化学方程式是 。
(3)该小组的甲、乙两位同学利用下图装置继续探究SO2及氯气漂白性:
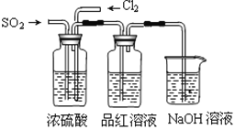
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,用离子方程式表示品红溶液不褪色的原因是: 。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是 ( )
A.电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C.氢氧化钡溶液中加入硫酸:Ba2++OH—+H++SO42—=BaSO4↓+H2O
D.鸡蛋壳浸泡在盐酸中产生气泡:CO32—+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅的热化学方程式如下:SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g)ΔH=+Q kJ·mol-1 (Q>0);某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是 ( )
Si(s)+4HCl(g)ΔH=+Q kJ·mol-1 (Q>0);某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为Q kJ
C.将反应的温度由T1升高至T2,则对应温度下的平衡常数K1>K2
D.当反应吸收热量为0.25Q kJ时,生成的HCl恰好与1 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的叙述正确的是 ( )
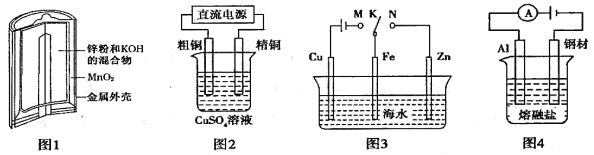
A.图1中,Zn—MnO2干电池放电时,MnO2被氧化
B.图2中,电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等
C.图4中,在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl7-形式存在,则阳极反应式为:Al -3e-+7AlCl4-=== 4Al2Cl7-
D.图3中,K分别与M、N连接,均可保护Fe电极,连接M时称为“牺牲阳极的阴极保护法”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。
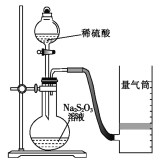
(已知:S2O32-+2H+ = H2O+S↓+SO2↑)
(1)除如图所示的实验用品、仪器外,还需要的一件实验仪器是__________________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是 。
(3)试简述测定该反应的化学反应速率的其他方法: (写一种)。
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。
(已知 I2+2S2O32- = S4O62-+2I-,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4)该实验进行的目的是 ,淀粉溶液的作用是 ,表中Vx= mL,通过比较t1、t2、t3大小,试推测该实验结论:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的NaNO3、Mg(NO3)2、Al(NO3)3三种溶液的体积比为3:2:1时,三种溶液中c(NO3-)之比为
A.1:1:1 B.1:2:3 C.3:2:1 D.3:4:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com